题目内容
工业纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,三位同学分别设计了甲、乙、丙三套实验装置(如图所示).测定的方法是:取一定质量的纯碱样品,加入足量的稀硫酸,产生的二氧化碳气体用足量的氢氧化钠溶液吸收.根据氢氧化钠溶液(盛装在甲、乙、丙装置中的Ⅰ、Ⅱ、Ⅲ瓶中)在实验前后的质量差,通过计算,确定碳酸钠的质量分数.操作时,甲、丙装置中气囊的空气可以根据需要排出装置中的气体.在滴加稀硫酸前,连接甲、乙、丙装置的a、b管口.上述装置中,________(填“甲”、“乙”或“丙”)装置能比较准确测得样品中碳酸钠的质量分数.请分别指出另外两套装置的一点不足:________.

答案:
解析:
提示:
解析:
|
丙;甲装置中产生的CO2气体有可能从长颈漏斗逸出(或空气中CO2无法排除).乙装置中反应后残留的CO2气体无法排出(或反应前空气中CO2无法排除). |
提示:
|
点拨:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ CO2+2NaOH=Na2CO3+H2O,根据NaOH溶液增重的CO2质量,求出Na2CO3的质量,再求出Na2CO3样品中Na2CO3质量分数.所以必须在实验前把容器内空气中CO2排出来,否则计算出现偏差. |

练习册系列答案
相关题目
工业纯碱中常含有食盐(主要成份为Na2CO3其余为NaCl).某化工厂为了测定一批纯碱中Na2CO3的质量分数,进行了以下分析实验:取纯碱样品置于烧杯中,加水充分溶解,慢慢滴加稀盐酸,至不发生气泡为止.有关数据如下表所示.求纯碱样品中Na2CO3的质量分数.
| 物质 | 样品质量 | 水的质量 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 22 | 50 | 56.8 | 120 |
 工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).
工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).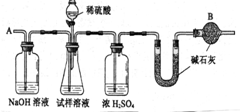 工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出.
工业纯碱中常含有微量的NaCl杂质,为测定其质量是否达到合格产品的要求,化学探究小组的同学配合国家“质量万里行”设计了如下实验方案.图中所使用的仪器和药品已由下面的装置图中给出. 工业纯碱中常含有少量的NaCl杂质.右下图是测定纯碱样品中Na2CO3质量分数的实验装置,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.(装置气密性良好,纯碱样品质量为11.0g,装置D反应前的质量为172.2g).
工业纯碱中常含有少量的NaCl杂质.右下图是测定纯碱样品中Na2CO3质量分数的实验装置,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.(装置气密性良好,纯碱样品质量为11.0g,装置D反应前的质量为172.2g).