题目内容
已知Cu+2H2SO4(浓)═CuSO4+2H2O+SO2↑若将湿润的蓝色石蕊试纸放在反应容器上方,看到的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
,若反应后的溶液小心倒入盛有少量水的烧杯中,观察到溶液的颜色是蓝色
蓝色
.若铜是足量的,该反应不能
不能
)填“能”或“不能”)消耗完所有的纯硫酸,理由是随着反应的进行,硫酸不断消耗,浓硫酸变成稀硫酸
随着反应的进行,硫酸不断消耗,浓硫酸变成稀硫酸
.分析:酸性气体能使湿润的蓝色石蕊试纸变蓝,硫酸铜溶液呈蓝色,铜与稀硫酸不反应.
解答:解:二氧化硫溶于水呈酸性,能使湿润的蓝色石蕊试纸变蓝,硫酸铜溶于水,溶液呈蓝色,铜与浓硫酸能反应,而与稀硫酸不能反应,随着反应的进行,硫酸不断消耗,浓硫酸变成稀硫酸,此时反应不能进行,因此不能消耗完所有的纯硫酸.
故答案为:蓝色石蕊试纸变红,蓝色. 不能 随着反应的进行,硫酸不断消耗,浓硫酸变成稀硫酸
故答案为:蓝色石蕊试纸变红,蓝色. 不能 随着反应的进行,硫酸不断消耗,浓硫酸变成稀硫酸
点评:本题考查指示剂的变色情况以及金属活动性顺序表.浓硫酸能与铜反应,而稀硫酸不能.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。
 |
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
①30℃时,向124 g K2CO3固体中加入100 g水,充分溶解后升温至40℃,该溶液中溶质的质量分数 (填“变大”、“变小”或“不变”)。
②曲线上M点的含义是 。
(2)某课外活动小组利用废铜制取硫酸铜,设计了如下两个方案:
| |||
 | |||
|
| |||
 | |||
方案二:②Cu CuSO4 [已知Cu + 2H2SO4(浓)= CuSO4 + SO2↑+2H2O]
从绿色化学的观点出发,你认为方案_________更合理,简述原因
。
(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
①30℃时,向124g K2CO3固体中加入100g水,充分溶解后升温至40℃,该溶液中溶质的质量分数 (填“变大”、“变小”或“不变”).
②曲线上M点的含义是 .
(2)某课外活动小组利用废铜制取硫酸铜,设计了如下两个方案:
方案一:Cu→CuO CuSO4
CuSO4
方案二:②Cu CuSO4[已知Cu+2H2SO4(浓)
CuSO4[已知Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O]
CuSO4+SO2↑+2H2O]
从绿色化学的观点出发,你认为方案 更合理,简述原因 .

| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
②曲线上M点的含义是 .
(2)某课外活动小组利用废铜制取硫酸铜,设计了如下两个方案:
方案一:Cu→CuO
 CuSO4
CuSO4方案二:②Cu
 CuSO4[已知Cu+2H2SO4(浓)
CuSO4[已知Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O]
CuSO4+SO2↑+2H2O]从绿色化学的观点出发,你认为方案 更合理,简述原因 .


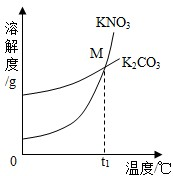 (2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.
(2013?历城区二模)(1)K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如图.