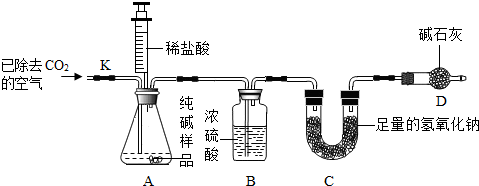
题目内容
小明要配制100 g溶质质量分数为18.5%的氯化钠溶液,如图是他配制该溶液的示意图.
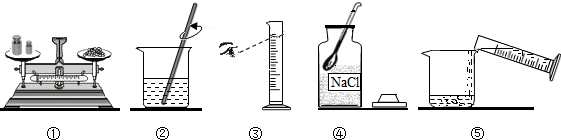
(1)图中共有 处错误(说明:天平的两个托盘上都垫有纸).
(2)量取所需要的水应选择 (选填“10mL”、“50mL”或“100mL”)量筒.
(3)用图示的序号表示配制溶液的操作顺序: .
(4)下列因素会使所配溶液溶质质量分数偏小的是 (填序号)
①药品和砝码放错了盘 ②量取水时仰视量筒刻度 ③所用烧杯内事先残留少量蒸馏水 ④将所配溶液转入试剂瓶时,不慎洒到外面少量.⑤使用粗盐代替氯化钠进行配制.

(1)图中共有
(2)量取所需要的水应选择
(3)用图示的序号表示配制溶液的操作顺序:
(4)下列因素会使所配溶液溶质质量分数偏小的是
①药品和砝码放错了盘 ②量取水时仰视量筒刻度 ③所用烧杯内事先残留少量蒸馏水 ④将所配溶液转入试剂瓶时,不慎洒到外面少量.⑤使用粗盐代替氯化钠进行配制.
考点:一定溶质质量分数的溶液的配制,测量容器-量筒,称量器-托盘天平
专题:溶液、浊液与溶解度
分析:(1)根据实验的注意事项进行解答;
(2)根据要确定所选的量筒,首先必须知道所要取水的体积进行解答;
(3)根据溶液配制的顺序进行解答;
(4)根据使所配溶液溶质质量分数偏小的原因可能是溶质少了或溶剂多了进行解答.
(2)根据要确定所选的量筒,首先必须知道所要取水的体积进行解答;
(3)根据溶液配制的顺序进行解答;
(4)根据使所配溶液溶质质量分数偏小的原因可能是溶质少了或溶剂多了进行解答.
解答:解:(1)用天平称量固体物质的质量时,应该将药品放在左盘,砝码在右盘,所以①错误;用量筒量取液体体积时,应该平视凹液面的最低处,故③错误;故答案为:2;
(2)配制100g质量分数为18.5%的氯化钠溶液,所需氯化钠的质量为100g×18.5%=18.5g,需要水的质量为100g-18.5g=81.5g,而水一般采用量体积的方法,所以水的体积为81.5mL,选择量筒时,应该超过所取液体的体积数且接近性原则,所以本题答案为:100mL;
(3)配制该溶液的操作顺序为计算、称量、量取、溶解,所以序号为④①③⑤②;故答案为:④①③⑤②;
(4)药品和砝码放错了盘、使用粗盐代替氯化钠进行配制,都会导致溶质质量减少,所以溶质质量分数偏小;量取水时仰视量筒刻度、所用烧杯内事先残留少量蒸馏水会导致溶剂质量增多,所以会使溶质质量分数偏小,而将所配溶液转入试剂瓶时,不慎洒到外面少量,溶液质量有损失,而溶质质量分数不变.
故答案为:①②③⑤.
(2)配制100g质量分数为18.5%的氯化钠溶液,所需氯化钠的质量为100g×18.5%=18.5g,需要水的质量为100g-18.5g=81.5g,而水一般采用量体积的方法,所以水的体积为81.5mL,选择量筒时,应该超过所取液体的体积数且接近性原则,所以本题答案为:100mL;
(3)配制该溶液的操作顺序为计算、称量、量取、溶解,所以序号为④①③⑤②;故答案为:④①③⑤②;
(4)药品和砝码放错了盘、使用粗盐代替氯化钠进行配制,都会导致溶质质量减少,所以溶质质量分数偏小;量取水时仰视量筒刻度、所用烧杯内事先残留少量蒸馏水会导致溶剂质量增多,所以会使溶质质量分数偏小,而将所配溶液转入试剂瓶时,不慎洒到外面少量,溶液质量有损失,而溶质质量分数不变.
故答案为:①②③⑤.
点评:本题考查了配制溶质质量分数一定的溶液,要合理选择所用的实验仪器和实验步骤,并且注意实验过程中正确实验操作的问题.

练习册系列答案
相关题目