题目内容
实验室有一瓶久置的NaOH固体,某同学设计实验探究其变质情况.
实验1:取样品少许于试管中,滴加稀盐酸有气泡产生,说明NaOH已变质.
实验2:另取一定量干燥的样品溶于水配成溶液,并加入适量的CaCl2溶液恰好完全反应,有关实验数据如表:
相对分子质量:Na2CO3-106 CaCl2-111 CaCO3-100
(1)该样品的变质情况是
(2)在不考虑水的情况下,若实验中得到的滤液中Cl-、OH-的个数分别是n1、n2,则Na+个数为
(3)计算加入的CaCl2溶液中的溶质质量分数.(用百分数表示,保留一位小数.)
实验1:取样品少许于试管中,滴加稀盐酸有气泡产生,说明NaOH已变质.
实验2:另取一定量干燥的样品溶于水配成溶液,并加入适量的CaCl2溶液恰好完全反应,有关实验数据如表:
| 反应前 | 反应后 | ||
| 实验 数据 |
干燥的样品质量 | 加入的CaCl2溶液质量 | 过滤、洗涤、干燥得滤渣的质量 |
| 8.0克 | 40.0克 | 5.0克 | |
(1)该样品的变质情况是
部分变质
部分变质
(选填“完全变质”或“部分变质”). 变质原因用化学方程式表示为CO2+2NaOH═Na2CO3+H2O
CO2+2NaOH═Na2CO3+H2O
.(2)在不考虑水的情况下,若实验中得到的滤液中Cl-、OH-的个数分别是n1、n2,则Na+个数为
n1+n2
n1+n2
.(3)计算加入的CaCl2溶液中的溶质质量分数.(用百分数表示,保留一位小数.)
分析:(1)氢氧化钠会与二氧化碳反应生成碳酸钠变质,假设完全变质为碳酸钠,根据所给样品的质量计算生成碳酸钠、及碳酸钠和氯化钙反应生成碳酸钙的质量,(可写出方程式,利用关系式求解)并与所给数据比较,判断是否完全变质
(2)根据溶液中阴、阳离子所带的正负电荷总数相等分析解答;
(3)依据生成沉淀的质量并结合碳酸钠与氯化钙反应的方程式计算氯化钙的质量,并据溶质的质量分数计算.
(2)根据溶液中阴、阳离子所带的正负电荷总数相等分析解答;
(3)依据生成沉淀的质量并结合碳酸钠与氯化钙反应的方程式计算氯化钙的质量,并据溶质的质量分数计算.
解答:解:(1)二氧化碳与氢氧化钠反应生成碳酸钠和水,方程式是:CO2+2NaOH═Na2CO3+H2O;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,方程式是:Na2CO3+CaCl2═CaCO3↓+2NaCl,假设氢氧化钠完全变质,设生成碳酸钙的质量为x,
由方程式可知:2NaOH~Na2CO3~CaCO3
80 100
8.0g x
=
解得x=10g,而题目中加入氯化钙溶液只生成5.0g沉淀,故氢氧化钠部分变质;
(2)实验得到的滤液中只含有阳离子Na+,Cl-、OH-的个数分别是n1、n2,所带的负电荷总数是n1+n2,所以Na+个数为n1+n2;
(3)设CaCl2溶液中CaCl2的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 5.0克
=
x=5.55克
CaCl2溶液中CaCl2的质量分数为:
×100%≈13.9%
故答案为:(1)部分变质; CO2+2NaOH═Na2CO3+H2O;
(2)n1+n2;
(3)加入的CaCl2溶液中的溶质质量分数为13.9%.
由方程式可知:2NaOH~Na2CO3~CaCO3
80 100
8.0g x
| 80 |
| 8.0g |
| 100 |
| x |
(2)实验得到的滤液中只含有阳离子Na+,Cl-、OH-的个数分别是n1、n2,所带的负电荷总数是n1+n2,所以Na+个数为n1+n2;
(3)设CaCl2溶液中CaCl2的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
x 5.0克
| 111 |
| x |
| 100 |
| 5.0克 |
x=5.55克
CaCl2溶液中CaCl2的质量分数为:
| 5.55克 |
| 40.0克 |
故答案为:(1)部分变质; CO2+2NaOH═Na2CO3+H2O;
(2)n1+n2;
(3)加入的CaCl2溶液中的溶质质量分数为13.9%.
点评:本题有一定难度,能根据方程式进行计算,并能根据题意灵活分析解答问题是解决问题的关键.

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
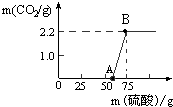 实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示.
实验室有一瓶久置的NaOH,称取13.3g 的NaOH样品(杂质为Na2CO3)于烧杯中,然后向烧杯中逐滴加入质量分数19.6%的稀硫酸,反应情况如图所示. 某校研究性学习小组进行了一个有趣的实验探究:
某校研究性学习小组进行了一个有趣的实验探究: 实验室有一瓶久置的氢氧化钠固体,某同学想了解它是否变质,设计了以下实验,请你与一起完成以下探究活动:
实验室有一瓶久置的氢氧化钠固体,某同学想了解它是否变质,设计了以下实验,请你与一起完成以下探究活动: