题目内容
具有相同原子数和电子数的分子或离子叫等电子体.已知氢、碳、氮、氧、硫、磷六种元素的原子序数分别为1、6、7、8、15、16,则下列各组粒子中不属于等电子体的是( )
分析:根据题目信息,具有相同原子数和电子数的分子或离子叫等电子体,而后利用分子中质子数等于电子数分析判断即可.
解答:解:A、CO的质子数为6+8=14,N2的质子数为7×2=14,分子中质子数等于电子数,是等电子体;
B、H2O分子中原子数为3,而NH3分子中原子数为4,所以不是等电子体;
C、NH4+质子数为7+4=11,电子数为10,CH4质子数为6+4=10,分子中质子数等于电子数,也为10,原子数都是5,所以是等电子体;
D、PO43-和SO42-电子数为50,原子数为5,所以是等电子体.
故选:B.
B、H2O分子中原子数为3,而NH3分子中原子数为4,所以不是等电子体;
C、NH4+质子数为7+4=11,电子数为10,CH4质子数为6+4=10,分子中质子数等于电子数,也为10,原子数都是5,所以是等电子体;
D、PO43-和SO42-电子数为50,原子数为5,所以是等电子体.
故选:B.
点评:通过回答本题知道了具有相同原子数和电子数的分子或离子叫等电子体,能利用等电子体对粒子进行正确的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ,它在化学反应中一般易
,它在化学反应中一般易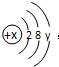 ,当x-y=8时,该粒子为
,当x-y=8时,该粒子为 ,它在化学反应中一般易
,它在化学反应中一般易 ,当x-y=10时,该粒子为
,当x-y=10时,该粒子为 ,它在化学反应中一般易
,它在化学反应中一般易 ,当x-y=8时,该粒子为
,当x-y=8时,该粒子为