题目内容
9.下列说法正确的是( )| A. | 14 g碳与32 g氧气反应,可以生成46 g二氧化碳 | |
| B. | 聚乙烯燃烧生成二氧化碳和水,所以聚乙烯是由碳、氢、氧三种元素组成的 | |
| C. | 蜡烛与氧气反应属于氧化反应,所以也是化合反应 | |
| D. | 水电解生成氢气和氧气分子个数比为2:1,所以水分子中氢、氧原子个数比为2:1 |
分析 A、质量守恒定律只适应与参加化学反应的物质,没有参加化学反应的不适用;
B、根据反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素进行解答;
C、根据质量守恒定律,反应前后元素种类不变,结合题意进行分析判断;
D、根据化学反应前后原子的个数不变进行解答;
解答 解:A、根据化学方程式可知32g氧气与12g碳恰好完全反应,质量守恒定律只能应用于参加化学反应的物质,故A错误;
B、反应物为聚乙烯和氧气,生成物为二氧化碳和水,氧气中含有氧元素,故根据质量守恒定律,聚乙烯中肯定含有碳、氢两种元素,可能含有氧元素,故B错误;
C、蜡烛燃烧生成二氧化碳和水,二氧化碳和水两种物质中含有碳、氧、氢三种元素,反应物中氧气是由氧元素组成的;根据质量守恒定律,反应前后,元素种类不变,则蜡烛中一定含有碳元素和氢元素,可能含有氧元素,故C错误;
D、根据质量守恒定律,化学反应前后原子的个数不变,反应后氢氧原子个数比为:2:1,故反应前氢氧原子个数比也为2:1,故D正确;
故选D.
点评 本题是对学过的多种知识的考查,同学们要熟记质量守恒定律的应用等才能正确解答本题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列物质中属于纯净物的是( )
| A. | 矿泉水 | B. | 蒸馏水 | C. | 自来水 | D. | 河水 |
20.化学用语是学习和交流化学知识的通用语言,以下化学符号表示原子的是( )
| A. | N2 | B. | H2 | C. | O2 | D. | Hg |
17.若三氧化硫和二氧化硫中含有相同质量的硫元素,则三氧化硫和二氧化硫的质量比是( )
| A. | 4:5 | B. | 5:6 | C. | 6:5 | D. | 5:4 |
14.取用80mL液体,应当选用的仪器是( )
| A. | 烧杯 | B. | 10 mL量筒 | C. | 100 mL量筒 | D. | 250 mL量筒 |
1.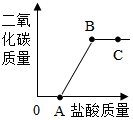 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )
 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量关系如图所示,下列有关说法正确的是( )| A. | OA段没有发生任何化学反应 | |
| B. | A点溶液中的溶质只有NaCl | |
| C. | C点的溶液的pH=7 | |
| D. | B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
19.钾肥能提高农作物抗倒伏、抗病虫害的能力,小明家的水稻出现了倒伏现象,应施用的肥料是( )
| A. | Ca(H2PO4)2 | B. | NH4H2PO4 | C. | CO(NH2)2 | D. | KCl |