题目内容
13.X、Y、Z是三种金属,根据下列有关化学方程式可知,①Z+YSO4═ZSO4+Y; ②X+YSO4═XSO4+Y;
③Z+H2SO4═ZSO4+H2↑; ④X+H2SO4不发生反应
三种金属的活动性有强到弱顺序是Z>X>Y.
分析 根据金属与另一种金属的盐溶液能否反应可判断两种金属的活动性的强弱.即活动性强的金属能把活动性弱的金属从其盐溶液中置换出来.排在氢前的金属能置换出酸中的氢,排在氢后的金属不能置换出酸中的氢
解答 解:根据①Z+YSO4=ZSO4+Y 可知 Z>Y.
根据②X+YSO4=XSO4+Y 可知X>Y.
根据③Z+H2SO4=ZSO4+H2↑可知Z在氢前
根据④X+H2SO4不发生反应 可知X在氢后.
故Z>X>Y.
故答案为:Z>X>Y.
点评 该题考查了学生对金属活动性顺序表的应用,要求学生要牢记活动性强的金属能把活动性弱的金属从其盐溶液中置换出来.即前换后.

练习册系列答案
相关题目
4.下列关于饱和溶液的说法中,正确的是( )
| A. | 饱和溶液就是不能再继续溶解溶质的溶液 | |
| B. | 同一溶质的饱和溶液一定比其不饱和溶液浓 | |
| C. | 热的饱和溶液降低温度时,一定会析出晶体 | |
| D. | 与溶质固体共存的溶液一定是饱和溶液 |
18.下列各项不随水质量的变化而变化的是( )
| A. | 溶液中溶质的质量分数 | |
| B. | 物质的溶解度 | |
| C. | 过量的氧化钠与水反应生成的氢氧化钠 | |
| D. | 酸溶液的pH |
2.下列物质在氧气中燃烧的现象,错误的是( )
| A. | 红磷在氧气中燃烧时,放出大量的热,产生大量白烟 | |
| B. | 木炭在氧气中燃烧时,发出耀眼白光,生成一种无色有刺激性气味的气体 | |
| C. | 铁丝在氧气中剧烈燃烧时,火星四射,放出大量的热,生成黑色固体 | |
| D. | 硫粉在氧气中燃烧时,发出蓝紫色火焰,放出大量的热,闻到刺激性气味 |
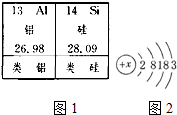 阅读材料,回答问题.
阅读材料,回答问题.