题目内容
在稀H2SO4、K2CO3、Ca(OH)2、CaCO3、Cu(NO3)2、Mg(OH)2、Zn中选择适当的物质,按要求写出反应的化学方程式:
(1)用难溶性碱制可溶性盐________
(2)用可溶性盐制有色金属________
(3)用一种盐制两种氧化物________
(4)用可溶性盐制可溶性碱________
答案:
解析:
解析:
|
(1) (2) (3) (4) |

练习册系列答案
相关题目



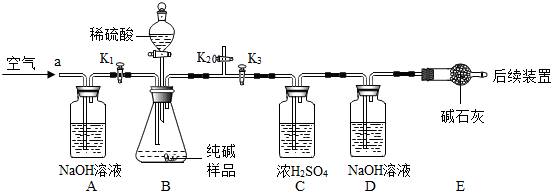
 (2012?常州)某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下:
(2012?常州)某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下: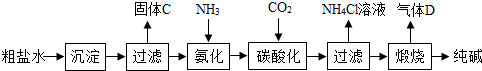


 2H2O+O2↑
2H2O+O2↑