题目内容
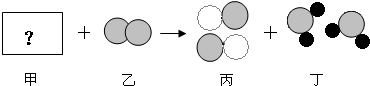
如下图所示:3个甲分子与1个乙分子反应生成两个丙分子。根据图示所得信息正确的是( )

A.物质甲的化学式为H6 B.该反应为化合反应
C.化学反应中分子是最小的微粒 D.该图示不符合质量守恒定律
B
【解析】
试题分析:根据反应的微观示意图可知,反应物中含有2个N原子,生成物中含有2个N原子和6个H原子;根据质量守恒定律,在化学变化前后原子的种类和数目不变,可知甲中含有6个H原子;再结合题意,“3个甲分子与1个乙分子反应生成两个丙分子”,可知每个甲分子是由两个H原子构成的,由此可知,甲分子为H2,乙分子是N2,丙分子是NH3,故该反应可表示为3H2+N2=2NH3。
A、每个甲分子由两个H原子构成,故物质甲的化学式为H2,错误;
B、该反应为两种物质反应,生成一种物质的化合反应,正确;
C、据图可知,反应前的分子为氢气分子和氮气分子,反应后的分子为氨气分子,故反应前后分子改变,错误;
D、该反应前后原子的种类和数目不变,因此反应符合质量守恒定律,错误。故选B
考点:微粒观点及模型图的应用,分子和原子的区别和联系,有关化学式的计算和推断,化合反应及其应用,质量守恒定律及其应用
点评:分子是由原子构成的,且同种原子构成的分子是单质分子,不同种原子构成的分子是化合物分子;化学反应的实质是分子分成原子,原子重新组合成新的分子的过程。试题通过给出微粒的模型,考查学生的观察能力和对基本概念的理解与运用能力,以检测考生从微观角度认识化学的意识和能力。


(1)30℃时,丙的溶解度是___________。
(2)20℃时,甲、乙、丙三种物质的溶解度按由大到小的顺序排列的是 。
(3)欲将20℃时丙不饱和溶液变为饱和溶液,可采用的方法是 (写出一种即可)。
(4)5℃时,取甲、乙、丙三种固体物质各20g分别加入盛有100g水的烧杯中,充分搅拌后得到的溶液,能够饱和的是_________________物质的溶液。又将三个烧杯中的混合物温度都升高到30℃,所得溶液溶质质量分数的大小关系是_______________。
(5)现要配制20℃时70g10%的甲溶液。该实验的部分操作如下图所示。

①需要称取甲的质量是________________,称量时图A出现了右盘低的现象,接下来的操作应该是____________________。
| A.左边的平衡螺丝向左调 | B.将游码向左移动 |
| C.右盘中减少砝码 | D.左盘中增加甲 |
③图C中用玻璃棒搅拌的作用是________________________。
(5分)某小组同学做“硫在氧气中燃烧”的实验时,老师建议在集气瓶底部放少量NaOH溶液吸收生成的SO2。这种做法引起了同学们的思考:SO2与NaOH是否发生反应。
【查阅资料】通常状况下,1体积水约能溶解40体积SO2。
【实验方案】同学们向充满SO2的软塑料瓶中倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑料瓶变瘪,他们认为SO2与NaOH发生了反应。
【反思与改进】甲同学认为上述实验不够严谨,理由是____________________。于是同学们设计了如下两个改进方案。
方案一
|
实验操作 |
实验现象 |
|
向两个充满SO2的200 mL软塑料瓶中分别注入10 mL的水和NaOH溶液,振荡、对比。 |
两个瓶子变瘪的程度 完全相同 |
乙同学认为由于两个瓶子变瘪的程度完全相同,因此无法证明SO2与NaOH是否发生了反应。试分析导致两个瓶子变瘪的程度完全相同的原因是_________________________________。他认为若改变注入水和NaOH溶液的体积便可达到实验目的,注入液体的体积可以是____(填序号)。
a.15 mL b.8 mL c.5 mL d.3 Ml
方案二
|
实验操作 |
实验现象 |
|
利用右图所示装置分别进行实验:向两个充满SO2的300 mL集气瓶中分别加入6 mL水和NaOH溶液,一段时间后,打开止水夹,对比。
|
倒吸入两个集气瓶中 的液体体积完全相同。 |
丙同学认为上述方案也无法证明SO2与NaOH是否发生反应。
你认为导致吸入液体的体积完全相同的原因是_________________________________。
丁同学思考后,将上述装置进行了改进,便可达到实验目的。
改进装置如下图所示,你认为装置B的作用是_________________________________。


 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)
表示氧原子)


 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)
表示氧原子)