题目内容
 KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:
KNO3和KCl在不同温度时的溶解度如表所示.请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(2)由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为
(4)40℃时,10000g饱和KCl溶液中溶质的质量分数为
(5)温度为
(6)t2℃时这两种物质饱和溶液中溶质的质量分数大的是
(7)如图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.硝酸铵固体 E.浓硫酸.
考点:固体溶解度曲线及其作用,溶解时的吸热或放热现象,晶体和结晶的概念与现象,溶质的质量分数、溶解性和溶解度的关系,生石灰的性质与用途
专题:溶液、浊液与溶解度
分析:固体溶解度曲线所能表示的意义:
①根据已知的温度可以查出有关物质的溶解度;
②根据物质的溶解度也可以查出它所对应的温度;
③可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小);
④根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并且,还可以判断或比较析出晶体的质量大小,即曲线越陡,析出的晶体就越多;
⑤两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的.
⑥冰块、硝酸铵固体溶于水吸热.
可以据此以上几点来完成解答.
①根据已知的温度可以查出有关物质的溶解度;
②根据物质的溶解度也可以查出它所对应的温度;
③可以判断或比较相同温度下,不同物质溶解度的大小(或饱和溶液中溶质的质量分数的大小);
④根据溶解度曲线,选择分离、提纯某些可溶性混合物的方法(即选用蒸发结晶还是降温结晶);并且,还可以判断或比较析出晶体的质量大小,即曲线越陡,析出的晶体就越多;
⑤两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的;并且,此时两种物质饱和溶液的溶质质量分数也相同的.
⑥冰块、硝酸铵固体溶于水吸热.
可以据此以上几点来完成解答.
解答:解:
(1)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故m能表示KNO3溶解度曲线.
(2)硝酸钾和氯化钾溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能,经分析知在20℃~30℃时这两种物质存在溶解度相同的可能.x的取值范围是34.0g<x<37.0g.
(3)10℃时,硝酸钾的溶解度为31g,10g水中最多能溶解3.1g硝酸钾.故蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g.
(4)40℃时,KCl的溶解度为40g,所以该温度下氯化钾的饱和溶液中溶质的质量分数为:
×100%=28.6%.由于溶液具有均一性和温度性,所以同一温度下的饱和溶液的溶质的质量分数是相同的,故40℃时,10000g饱和KCl溶液中溶质的质量分数为28.6%.
(5)据图知t1℃时,两物质的溶解度相同,故KNO3饱和溶液和KCl饱和溶液溶质的质量分数相同;
(6)据图知,t2℃时硝酸钾的溶解度大于氯化钾的溶解度,故t2℃时这两种物质饱和溶液中溶质的质量分数大的是KNO3;
(7)因为硝酸钾的溶解度随温度升高而增大,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,说明硝酸钾的溶解度变小了,温度降低了,即该物质溶于水吸收热量,使温度降低,氢氧化钠固体、生石灰、浓硫酸溶于水,都放出热量,使温度升高,所以都不行;冰块溶于水会使温度降低,硝酸铵溶于水吸热,会使溶液温度降低,故应填CD.
故答案为:
(1)m;(2)34.0g<x<37.0g;(3)3.1g;(4)28.6%;(5)t1℃;(6)KNO3;(7)CD.
(1)根据表中的信息可确定硝酸钾的溶解度随温度变化明显,而氯化钾的溶解度随温度变化很不明显,故m能表示KNO3溶解度曲线.
(2)硝酸钾和氯化钾溶解度相同的温度既是判断该段中溶解度的数值是否存在相等的可能,经分析知在20℃~30℃时这两种物质存在溶解度相同的可能.x的取值范围是34.0g<x<37.0g.
(3)10℃时,硝酸钾的溶解度为31g,10g水中最多能溶解3.1g硝酸钾.故蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为3.1g.
(4)40℃时,KCl的溶解度为40g,所以该温度下氯化钾的饱和溶液中溶质的质量分数为:
| 40g |
| 100g+40g |
(5)据图知t1℃时,两物质的溶解度相同,故KNO3饱和溶液和KCl饱和溶液溶质的质量分数相同;
(6)据图知,t2℃时硝酸钾的溶解度大于氯化钾的溶解度,故t2℃时这两种物质饱和溶液中溶质的质量分数大的是KNO3;
(7)因为硝酸钾的溶解度随温度升高而增大,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,说明硝酸钾的溶解度变小了,温度降低了,即该物质溶于水吸收热量,使温度降低,氢氧化钠固体、生石灰、浓硫酸溶于水,都放出热量,使温度升高,所以都不行;冰块溶于水会使温度降低,硝酸铵溶于水吸热,会使溶液温度降低,故应填CD.
故答案为:
(1)m;(2)34.0g<x<37.0g;(3)3.1g;(4)28.6%;(5)t1℃;(6)KNO3;(7)CD.
点评:解答这类题目时,首先,要熟记和理解固体溶解度曲线及其使用,固体溶解度的概念和意义,溶质质量分数及其有关计算,饱和溶液和不饱和溶液的概念及其相互转变方法,根据所给的问题情景或结合所学的相关知识和技能,按照题目的要求,认真地进行选择或解答即可.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列自然现象,属于化学变化的是( )
| A、冰川消融 | B、火药爆炸 |
| C、瓷碗破碎 | D、铜丝弯曲 |
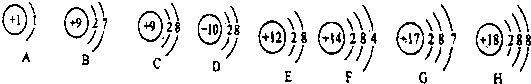
 原子在化学反应中容易
原子在化学反应中容易
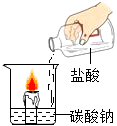 在化学学习中,我们以“透过现象看本质”的认识物质与变化.
在化学学习中,我们以“透过现象看本质”的认识物质与变化.