题目内容
13.通过对碳与碳的化合物的学习我们知道了:金刚石、石墨、C60都是由碳元素组成的单质.它们的化学性质相似,如都有可燃性,试写出C60在空气中完全燃烧的化学方程式C60+60O2$\frac{\underline{\;高温\;}}{\;}$60CO2.防毒面具中含有活性炭是利用了它的吸附性. CO2和CO性质不同是因为分子构成不同.分析 根据元素组成物质,碳单质和氧气在点燃的条件下生成二氧化碳,活性炭具有吸附性等知识进行分析.
解答 解:金刚石、石墨、C60都是由碳元素组成的单质,C60和氧气在点燃的条件下生成二氧化碳,化学方程式为:C60+60O2$\frac{\underline{\;高温\;}}{\;}$60CO2,防毒面具中含有活性炭是利用了它的吸附性,CO2和CO性质不同是因为:分子构成不同.
故答案为:碳元素,C60+60O2$\frac{\underline{\;高温\;}}{\;}$60CO2,吸附,分子构成不同.
点评 本题主要考查了碳单质的一些性质,难度不大,需要认真识记即可完成.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
18.下列变化,属于化学变化的是( )
| A. | 蔬菜榨汁 | B. | 冰雪融化 | C. | 燃放烟花 | D. | 食盐的溶解 |
2.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:有Na2SO4、H2SO4和NaOH
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:Na2SO4.
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想一,其理由是H2SO4和NaOH在溶液中不能共存
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究中存在操作错误,请大家反思.同学们经过反思发现了这错误:实验操作中的错误是①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:有Na2SO4、H2SO4和NaOH
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH
猜想四:Na2SO4.
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想一,其理由是H2SO4和NaOH在溶液中不能共存
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 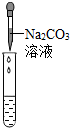 | 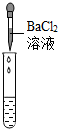 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验探究中存在操作错误,请大家反思.同学们经过反思发现了这错误:实验操作中的错误是①pH试纸浸入溶液中;②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
3. 向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
 向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )| 烧杯中的物质 | x溶液 | |
| A | 碳酸钠和氢氧化钠溶液 | 稀盐酸 |
| B | 稀硫酸和稀盐酸 | 氯化钡溶液 |
| C | 镁铝合金 | 稀盐酸 |
| D | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |

 如图为一种有机物(苯酚)的分子模型,苯酚的稀溶液具有杀菌防腐的功能.
如图为一种有机物(苯酚)的分子模型,苯酚的稀溶液具有杀菌防腐的功能. ,它在化学反应中容易形成O2-.
,它在化学反应中容易形成O2-.