题目内容
含锌65%的锌粒200g,与足量的稀H2SO4反应生成硫酸锌和氢气,求:可制得H2多少升?(标况下ρ(H2)=0.09g/L)
解:设可制得氢气的质量为x 克,
Zn+H2SO4═ZnSO4+H2↑
65 2
200g×65% x
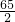 =
= 解得 x=4 g
解得 x=4 g
氢气在标准状况下的体积为:4g÷0.09g/L=44.4L;
答:制得的氢气在标准状况下的体积为 44.4L.
分析:根据锌与稀H2SO4反应的化学方程式得出各物质之间的质量比,列出比例式,计算得出生成氢气的质量,依据体积=质量÷密度 计算即可解答.
点评:本题主要考查学生运用化学方程式和物质的密度公式进行分析解题的能力.
Zn+H2SO4═ZnSO4+H2↑
65 2
200g×65% x
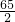 =
= 解得 x=4 g
解得 x=4 g氢气在标准状况下的体积为:4g÷0.09g/L=44.4L;
答:制得的氢气在标准状况下的体积为 44.4L.
分析:根据锌与稀H2SO4反应的化学方程式得出各物质之间的质量比,列出比例式,计算得出生成氢气的质量,依据体积=质量÷密度 计算即可解答.
点评:本题主要考查学生运用化学方程式和物质的密度公式进行分析解题的能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 、
、 的混合溶液来制取饱和
的混合溶液来制取饱和