题目内容
16.向装有少量NaOH溶液的试管中加入少量的盐酸,振荡,再滴入1-2滴无色酚酞溶液,振荡,无色酚酞溶液不变色,此时溶液pH可能是( )| A. | 12.1 | B. | 7.1 | C. | 4.4 | D. | 10 |
分析 氢氧化钠与稀盐酸发生中和反应生成氯化钠和水,滴入1-2滴无色酚酞溶液,振荡,无色酚酞溶液不变色,无色酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,说明溶液显酸性或中性,据此进行分析判断.
解答 解:向装有少量NaOH溶液的试管中加入少量的盐酸,振荡,氢氧化钠与稀盐酸发生中和反应生成氯化钠和水,滴入1-2滴无色酚酞溶液,振荡,无色酚酞溶液不变色,说明溶液显酸性或中性.
A、pH是12.1,溶液显碱性,遇无色酚酞溶液变红色,故选项错误.
B、pH是7.1,溶液显碱性,遇无色酚酞溶液变红色,故选项错误.
C、pH是4.4,溶液显酸性,遇无色酚酞溶液显无色,故选项正确.
D、pH是10,溶液显碱性,遇无色酚酞溶液变红色,故选项错误.
故选:C.
点评 本题难度不大,掌握中和反应的原理、溶液的酸碱性和溶液pH大小之间的关系是正确解答本题的关键.

练习册系列答案
相关题目
18.葡萄糖的化学式为C6H12O6.下列有关葡萄糖的说法错误的是( )
| A. | 葡萄糖是有机化合物 | |
| B. | 葡萄糖由碳、氢、氧三种元素组成 | |
| C. | 葡萄糖中碳、氢、氧三种元素的质量比为6:1:8 | |
| D. | 葡萄糖的相对分子质量是180g |
4.2017年1月《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”.口罩使用过程中,涂层中的氯化钠在溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,氯化钠会再次析出.请从26-A或26-B两题中任选1个作答,若两题均作答,按26-A计分.
| 26-A | 26-B |
| (1)钠原子转化为钠离子, 其核外电子数变小(填“变大”或“变小”). (2)常温下,氯化钠饱和溶液中,氯化钠与水的质量比为9:25 . (已知:常温下,氯化钠的溶解度为36g) | (1)构成氯化钠的微粒是Na+和Cl-(填微粒符号). (2)口罩使用过程中,氯化钠溶液中溶质的质量分数改变(填“改变”或“不变”) |
8.实验室常用的制取气体的发生装置如下:
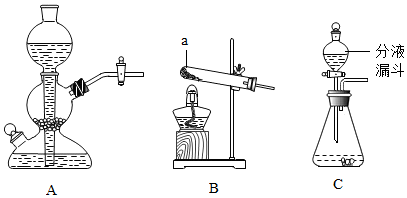
①仪器a的名称是试管;搭建B装置时,酒精灯应在固定仪器a之前(选填“前”或“后”)放置.
②实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③在实验室制取二氧化碳的研究中,进行了如下实验:
Ⅰ.上述实验中反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑.
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是大理石的状态.
Ⅳ.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是ad(选填编号)
a.反应更为剧烈
b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大
d.粉末状大理石利用率更高
④表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因.

①仪器a的名称是试管;搭建B装置时,酒精灯应在固定仪器a之前(选填“前”或“后”)放置.
②实验室用过氧化氢溶液和二氧化锰混合制取氧气,反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③在实验室制取二氧化碳的研究中,进行了如下实验:
| 甲 | 乙 | 丙 | 丁 | |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是大理石的状态.
Ⅳ.研究发现酸的浓度越大,产生气体的速度越快,与甲比较,对丁分析正确的是ad(选填编号)
a.反应更为剧烈
b.最终剩余溶液的质量更小
c.产生二氧化碳的质量更大
d.粉末状大理石利用率更高
④表中的两个实验,尽管在原料状态、发生装置等方面存在差异,却都能控制气体较平稳的产生.请从实验目的、原理、原料、装置、操作等方面思考后,具体阐述每个实验中气体较平稳产生的最主要的一个原因.
| 目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
| 制取二氧化碳 | 块状大理石稀盐酸 | A | 固体药品的状态和溶液的浓度有关 |
| 制取氧气 | 粉末状二氧化锰3%的过氧化氢溶液 | C | 二氧化锰起催化作用 |
6.下列常见物质的俗名与化学式对应正确的是( )
| A. | 烧碱一一NaOH | B. | 小苏打一一Na2SO4 | ||
| C. | 熟石灰一一CaCl2 | D. | 碳铵一一(NH4)2CO3 |