题目内容
根据所学金属的有关性质和图示实验,回答问题:
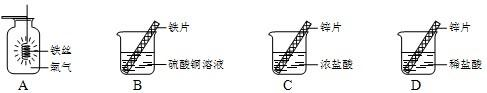
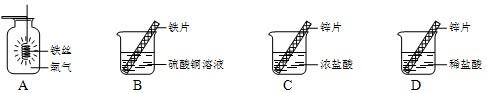
(1)实验A中反应的主要实验现象是 ,化学方程式为 .
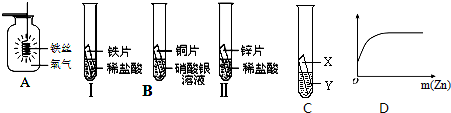
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如图B三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
(2)一段时间后,可明显观察到实验Ⅱ的现象是 ;反应的化学方程式是 .
(3)小组中的同学甲认为:通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱.他依据的实验现象是 .
(4)乙和丙两位同学认为上述三个实验不能够得出四种金属的活动性顺序,原因是 ;并在上述实验的基础上,补充了一个实验(如图C所示),实现了探究目的.他们的实验设计是:X是金属 ,Y是 溶液(写出化学式).
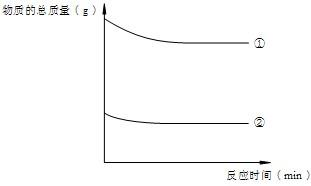
(5)在完成实验任务后,该小组又进行了深入的实验探究.他们向一定质量的稀盐酸中加入锌粉至过量.最后将所得的实验数据绘制成了图象(如图D).请你帮助他们确定横坐标和纵坐标表示的量:若横坐标表示加入锌粉的质量,则纵坐标表示 .
A、氢气的质量;B、溶液的质量;C、稀盐酸的质量;D、生成的氯化锌的质量分数.

(1)实验A中反应的主要实验现象是
在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如图B三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
(2)一段时间后,可明显观察到实验Ⅱ的现象是
(3)小组中的同学甲认为:通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱.他依据的实验现象是
(4)乙和丙两位同学认为上述三个实验不能够得出四种金属的活动性顺序,原因是
(5)在完成实验任务后,该小组又进行了深入的实验探究.他们向一定质量的稀盐酸中加入锌粉至过量.最后将所得的实验数据绘制成了图象(如图D).请你帮助他们确定横坐标和纵坐标表示的量:若横坐标表示加入锌粉的质量,则纵坐标表示
A、氢气的质量;B、溶液的质量;C、稀盐酸的质量;D、生成的氯化锌的质量分数.
分析:根据铁在氧气中燃烧的现象、反应的化学方程式进行分析解答即可.
金属活动性的探究要通过彼此之间的相互反应等来进行验证.要对实验进行分析综合,看能否将相对应的物质全部排好顺序,如不能,则方案就需要进一步完善.在完善时,要对上面验证过程中缺失的环节补充即可.
金属活动性的探究要通过彼此之间的相互反应等来进行验证.要对实验进行分析综合,看能否将相对应的物质全部排好顺序,如不能,则方案就需要进一步完善.在完善时,要对上面验证过程中缺失的环节补充即可.
解答:解:(1)解:铁在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2
Fe3O4.
(2)一段时间后,可明显观察到实验Ⅱ锌与稀盐酸反应的现象是 产生大量气泡,锌片逐渐减小;反应的化学方程式是 Zn+2HCl=ZnCl2+H2↑
.
(3)因为金属与酸反应的速度越快说明该金属越活泼;故通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱;
(4)第Ⅰ个实验说明铁排在了氢的前面,图B实验说明铜排在银的前面,第Ⅱ个实验说明锌排在了氢的前面,这两个同时都反应,就要注意在相同条件(题干特别注明:所用金属的形状与大小及稀盐酸的质量分数和用量均相同)下反应速率的大小,反应越快就证明该金属就越活泼,锌比铁反应要快,所以Zn>Fe.图B铜片和硝酸银反应,说明Cu>Ag.这样我们还无法知道Fe和Cu之间的活动性关系,所以在补充实验时就需要设计与Fe和Cu活动性有关的.
在设计补充实验验证Fe和Cu活动性时,既可以让两者之间直接反应验证(如Fe和可溶性铜盐如CuCl2、Cu(NO3)2、CuSO4或者铜和可溶性亚铁盐溶液反应如FeCl2、FeSO4、Fe(NO3)2等),也可以让铜和稀盐酸反应,因为上面有该药品所以较为方便.同样也可以比照上面Fe和Zn的验证方式,象②一样将铁丝插入到硝酸银中(硝酸银的质量分数和体积都要相同),和②对比生成白色物质的速率.这些方案都可以,要考虑药品的便捷性.
(5)锌与盐酸反应时由于反应前没有氢气,所以氢气的质量曲线应该从零点开始,没加入锌前溶液是盐酸溶液,加入锌后溶液变为氯化锌溶液,质量增大了,当反应完毕溶液质量就不变了,所以B是正确的,由于锌是过量的,所以最后盐酸被全部反应掉了,所以C不正确,在没加入锌前没有氯化锌,所以氯化锌的曲线应该从零点开始.
故答案为:
(1)剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,3Fe+2O2
Fe3O4.
(2)产生大量气泡,锌片逐渐减小; Zn+2HCl=ZnCl2+H2↑.
(3)实验Ⅱ中产生气体的速率比实验Ⅰ的快.
(4)无法比较Fe和Cu的活动性;Fe,CuSO4(其他可溶性铜盐也可).或者Cu,FeCl2(其他可溶性亚铁盐也可).或者Cu,HCl(以上方案是看反应是否发生) Fe,AgNO3 (是和②实验对比金属表面白色物质的生成速率)
(5)B
| ||
(2)一段时间后,可明显观察到实验Ⅱ锌与稀盐酸反应的现象是 产生大量气泡,锌片逐渐减小;反应的化学方程式是 Zn+2HCl=ZnCl2+H2↑
.
(3)因为金属与酸反应的速度越快说明该金属越活泼;故通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱;
(4)第Ⅰ个实验说明铁排在了氢的前面,图B实验说明铜排在银的前面,第Ⅱ个实验说明锌排在了氢的前面,这两个同时都反应,就要注意在相同条件(题干特别注明:所用金属的形状与大小及稀盐酸的质量分数和用量均相同)下反应速率的大小,反应越快就证明该金属就越活泼,锌比铁反应要快,所以Zn>Fe.图B铜片和硝酸银反应,说明Cu>Ag.这样我们还无法知道Fe和Cu之间的活动性关系,所以在补充实验时就需要设计与Fe和Cu活动性有关的.
在设计补充实验验证Fe和Cu活动性时,既可以让两者之间直接反应验证(如Fe和可溶性铜盐如CuCl2、Cu(NO3)2、CuSO4或者铜和可溶性亚铁盐溶液反应如FeCl2、FeSO4、Fe(NO3)2等),也可以让铜和稀盐酸反应,因为上面有该药品所以较为方便.同样也可以比照上面Fe和Zn的验证方式,象②一样将铁丝插入到硝酸银中(硝酸银的质量分数和体积都要相同),和②对比生成白色物质的速率.这些方案都可以,要考虑药品的便捷性.
(5)锌与盐酸反应时由于反应前没有氢气,所以氢气的质量曲线应该从零点开始,没加入锌前溶液是盐酸溶液,加入锌后溶液变为氯化锌溶液,质量增大了,当反应完毕溶液质量就不变了,所以B是正确的,由于锌是过量的,所以最后盐酸被全部反应掉了,所以C不正确,在没加入锌前没有氯化锌,所以氯化锌的曲线应该从零点开始.
故答案为:
(1)剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,3Fe+2O2
| ||
(2)产生大量气泡,锌片逐渐减小; Zn+2HCl=ZnCl2+H2↑.
(3)实验Ⅱ中产生气体的速率比实验Ⅰ的快.
(4)无法比较Fe和Cu的活动性;Fe,CuSO4(其他可溶性铜盐也可).或者Cu,FeCl2(其他可溶性亚铁盐也可).或者Cu,HCl(以上方案是看反应是否发生) Fe,AgNO3 (是和②实验对比金属表面白色物质的生成速率)
(5)B
点评:本题主要考查铁生锈的条件、化学方程式的书写、金属活动性顺序的应用等方面的知识,实验方案设计要考虑各种可行性方案,然后在方案中寻找最佳的方案付诸实施.不同的方案的原理也不尽相同,所以要勤思考,多总结.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目