题目内容
【题目】2019年12月17日,我国首艘国产航母在海南三亚某军港交付海军,命名为“中国人民解放军海军山东舰”,舷号“17”。
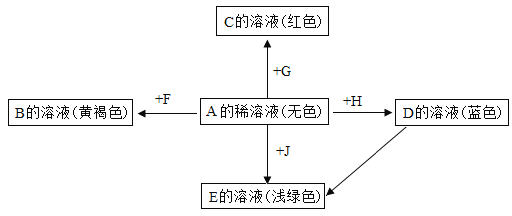
(1)铜运用于航母的电力系统是利用了铜的_____________性。
(2)在硫酸铜和硝酸银的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤渣和滤液。
①写出上述反应中一定会发生的反应的化学方程式:_______________。
②若向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是_______________。
【答案】导电 ![]() 银、铜、锌
银、铜、锌
【解析】
(1)铜运用于航母的电力系统是利用了铜的导电性。故填:导电;
(2)①金属活动性:锌>铜>银,在硫酸铜和硝酸银的混合溶液中加入一定质量的锌粉,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完全后,锌再与硝酸铜反应生成硝酸锌和铜,所以一定会发生的反应是锌与硝酸银反应,反应的化学方程式为![]() ;故填:
;故填:![]() ;
;
②若向滤渣中滴加稀盐酸,有气泡产生,说明锌过量,硝酸铜和硝酸银被全部反应完全,则滤渣中一定含有的物质是银、铜、锌。故填:银、铜、锌。

【题目】某兴趣小组的同学在实验室看到了一瓶久置的过氧化钠,发现它已变为白色粉末,同学们决定对该白色粉末的成分进行探究:
[提出问题]白色粉末含有哪些成分?
[查阅资料]①过氧化钠(Na2O2)为淡黄色粉末;②过氧化钠与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气;③碳酸钡、碳酸钙不溶于水。
[猜想与假设]
猜想一:白色粉末含有Na2O2和NaOH;
猜想二:白色粉末只有NaOH;
猜想三:白色粉末只有Na2CO3 ;
猜想四:白色粉末含有_________________。
[交流与讨论]
同学们认为猜想一不正确,原因是_________________;但小何同学认为仅靠视觉判断物质的组成不可靠,要通过实验来确认有无Na2O2。
[实验探究]小组同学设计了如下实验方案,请完成相关内容:
步骤 | 实验操作 | 实验现象 | 结论 |
① | 取少量样品于试管中,滴加适量的水 | ________ | 白色粉末不含有Na2O2 |
② | 取少量样品于试管中溶解,滴入足量的CaCl2溶液 | ________ | 白色粉末含有Na2CO3 |
③ | 取步骤②中反应后的上层清液,滴入________ | 溶液变红 | 白色粉末含有NaOH |
[实验结论]由上述实验可知猜想四成立,该粉末已全部变质。
[反思拓展]写出步骤②中发生反应的化学方程式:_________________。
【题目】利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 | 实验步骤 |
| Ⅰ.集气瓶的容积为250mL,实验开始前在集气瓶内加入50mL蒸馏水;在燃烧匙内加入足量白磷,塞紧瓶塞;取下注射器,吸入足量的、红颜色的水,再连接好装置。 Ⅱ.将组装好的实验装置转移到80℃热水中浸泡,片刻后白磷燃烧。 Ⅲ.待白磷熄灭后,再将整套装置放入冷水中冷却至室温。 |
(1)组装仪器后,用手向上拉动注射器活塞。松开手后,观察到________________,说明此装置气密性良好。
(2)冷却后进入集气瓶的红颜色的水的体积是_____mL。
(3)若在以上实验过程中,同时完成“验证可燃物燃烧需要满足温度达到着火点的条件”,还需补充的实验操作及现象是_______________________。