题目内容
天然气的主要成分是甲烷,标准状况下25L某种天然气完全燃烧时需要消耗190L空气.已知标准状况下甲烷的密度为0.717g/L,氧气的密度为1.43g/L,试求:
(1)该天然气中甲烷的体积分数(计算结果取整数即可,下同).
(2)已知每16g甲烷完全燃烧可放出890kJ热量,计算25L天然气中所含的甲烷完全燃烧所放出的热量是多少千焦?
(1)该天然气中甲烷的体积分数(计算结果取整数即可,下同).
(2)已知每16g甲烷完全燃烧可放出890kJ热量,计算25L天然气中所含的甲烷完全燃烧所放出的热量是多少千焦?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据题意,标准状况下25L某种天然气完全燃烧时需要消耗190L空气,已知标准状况下甲烷的密度为0.717g/L,氧气的密度为1.43g/L,据此结合甲烷燃烧的化学方程式,计算出25L天然气中甲烷的质量,进行分析解答即可.
(2)已知每16g甲烷完全燃烧可放出890kJ热量,据此可计算出25L天然气中所含的甲烷完全燃烧所放出的热量.
(2)已知每16g甲烷完全燃烧可放出890kJ热量,据此可计算出25L天然气中所含的甲烷完全燃烧所放出的热量.
解答:解:(1)190L空气中氧气的质量:190L×21%×1.43g/L≈57.1g.
设25L天然气中甲烷的质量为x
CH4+2O2
CO2+2H2O
16 64
x 57.1g
=
x≈14.3g
该天然气中甲烷的体积分数为
×100%≈80%.
(2)已知每16g甲烷完全燃烧可放出890kJ热量,则25L天然气中所含的甲烷完全燃烧所放出的热量是
×14.3g≈795kJ.
答:(1)天然气中甲烷的体积分数为80%
(2)25L天然气中所含的甲烷完全燃烧所放出的热量是795kJ.
设25L天然气中甲烷的质量为x
CH4+2O2
| ||
16 64
x 57.1g
| 16 |
| 64 |
| x |
| 57.1g |
该天然气中甲烷的体积分数为
| 14.3g÷0.717g/L |
| 25L |
(2)已知每16g甲烷完全燃烧可放出890kJ热量,则25L天然气中所含的甲烷完全燃烧所放出的热量是
| 890kJ |
| 16g |
答:(1)天然气中甲烷的体积分数为80%
(2)25L天然气中所含的甲烷完全燃烧所放出的热量是795kJ.
点评:本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
某同学用托盘天平称取16.5g药品,在称量中发现指针向左偏转,他应该( )
| A、加药品 | B、减少药品 |
| C、加砝码 | D、调节平衡螺母 |
测定生活中一些物质的pH,结果如图.下列说法错误的是( )


| A、食醋可以用于去除水垢 |
| B、胃酸过多的人不宜多吃柠檬 |
| C、草木灰水能使紫色石蕊试液变红 |
| D、清洁剂为强酸或强碱 |
铜、汞、铅等重金属能使人中毒,如误入口中应采取的急救措施是( )
| A、喝大量牛奶 |
| B、喝大量葡萄糖水 |
| C、喝大量白开水 |
| D、喝大量食盐水 |
下列仪器中,用作少量试剂反应容器,在常温或加热时使用的是( )
| A、胶头滴管 | B、锥形瓶 |
| C、试管 | D、蒸发皿 |
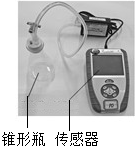 同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.
同学们通过查阅资料知道,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液和土豆中含有的过氧化氢酶.同学们通过如下实验进行相关研究.