题目内容
 (2011?大庆)有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如右图所示.下列说法正确的是( )
(2011?大庆)有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如右图所示.下列说法正确的是( )分析:根据图象可以得出产生氢气的量一样多,而不同酸中酸的质量分数相同,则酸中氢元素的质量相同,可以判断出两种金属中有一种剩余,然后根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系.
解答:解:A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,而锌没有剩余.故A错误;
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据图象可以得到,最终产生的氢气的质量相等,故C正确;
D、由于锌的相对原子质量大,因此得到相同质量的氢气,参加反应的金属锌的质量要大一些,则消耗的镁与锌的质量
之比不等于1:1,故D错误;
故选BC.
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据图象可以得到,最终产生的氢气的质量相等,故C正确;
D、由于锌的相对原子质量大,因此得到相同质量的氢气,参加反应的金属锌的质量要大一些,则消耗的镁与锌的质量
之比不等于1:1,故D错误;
故选BC.
点评:本题难度较大,主要考查了金属与酸的反应,注意图象中的信息是解答本题的关键,明确氢气的质量相等及二价金属与酸反应的方程式来计算,培养了学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 (2011?大庆)社会上曾经出现过有些不法分子用假金元宝骗取路人财物的案件.假设假金元宝为Cu和Zn的合金.甲、乙、丙三位同学为了测定假金元宝中锌的质量分数设计了如下实验步骤:
(2011?大庆)社会上曾经出现过有些不法分子用假金元宝骗取路人财物的案件.假设假金元宝为Cu和Zn的合金.甲、乙、丙三位同学为了测定假金元宝中锌的质量分数设计了如下实验步骤:
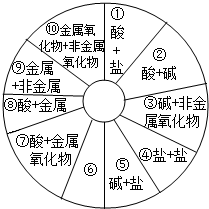 (2011?大庆)单质、氧化物、酸、碱、盐,这些不同类别的物质之间反应时都可以生成盐,现有同学构建了如图所示的知识网络图.
(2011?大庆)单质、氧化物、酸、碱、盐,这些不同类别的物质之间反应时都可以生成盐,现有同学构建了如图所示的知识网络图.