题目内容
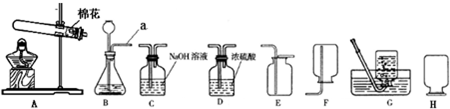
现有下列实验装置,请根据要求回答:
(1)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为
(2)写出使用AE装置制取气体的化学反应方程式:
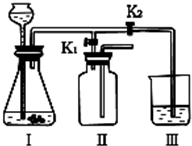
(3)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质.
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
a.大理石与稀盐酸反应制取收集二氧化碳b.锌与稀硫酸反应制取收集氢气c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入
(4)现有7.5g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如下图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)该石灰石样品中碳酸钙的质量分数是多少?

(1)实验室若使用盐酸和金属锌制取氢气,化学反应方程式为
Zn+2HCl═ZnCl2 +H2↑
Zn+2HCl═ZnCl2 +H2↑
,这种方法制得的氢气往往含有少量氯化氢气体,原因是盐酸具有挥发性
盐酸具有挥发性
,可将气体通过装置C
C
除去氯化氢气体;(2)写出使用AE装置制取气体的化学反应方程式:
2KMnO4
K2MnO4 +MnO2 +O2↑
| ||
2KMnO4
K2MnO4 +MnO2 +O2↑
.
| ||
(3)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质.

①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是
b
b
(填字母).a.大理石与稀盐酸反应制取收集二氧化碳b.锌与稀硫酸反应制取收集氢气c.用氯酸钾与二氧化锰共同加热制取收集氧气
②当打开K2、关闭K1时,可以利用Ⅰ、Ⅲ装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入
紫色石蕊试液
紫色石蕊试液
.(4)现有7.5g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如下图所示.(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)该石灰石样品中碳酸钙的质量分数是多少?
分析:(1)锌和盐酸反应生成氯化锌和氢气,盐酸具有挥发性,氯化氢气体溶于水形成盐酸可与氢氧化钠溶液反应而被除去;
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,据反应原理书写方程式;
(3)①当打开K1、关闭K2时,从图中的收集装置进气管短可看出,制取的气体密度要小于空气的密度;
②利用二氧化碳与水反应形成酸的性质,用石蕊试液检验;
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g,据二氧化碳的质量结合方程式可计算出样品中碳酸钙的质量,进而计算出碳酸钙的质量分数.
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,据反应原理书写方程式;
(3)①当打开K1、关闭K2时,从图中的收集装置进气管短可看出,制取的气体密度要小于空气的密度;
②利用二氧化碳与水反应形成酸的性质,用石蕊试液检验;
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g,据二氧化碳的质量结合方程式可计算出样品中碳酸钙的质量,进而计算出碳酸钙的质量分数.
解答:解:(1)锌和盐酸反应生成氯化锌和氢气,方程式是:Zn+2HCl═ZnCl2 +H2↑;盐酸具有挥发性,故制得的气体中混有少量氯化氢气体,而氯化氢气体溶于水形成盐酸可与氢氧化钠溶液反应而被除去,所以可将气体通过氢氧化钠溶液除掉氯化氢气体;
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,方程式是2KMnO4
K2MnO4 +MnO2 +O2↑;
(3)①从图中可以看出Ⅱ中进气管短,说明生成的气体的密度要小于空气的密度.b中所制取的氢气密度小于空气的密度,所以选b;
②二氧化碳溶于水后形成碳酸,碳酸可使紫色石蕊试液变红.我们可利用这一性质检验二氧化碳与水的反应;
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g;
设7.5克石灰石中碳酸钙的质量为x
CaCO3 +2HCl═CaCl2 +H2O+CO2↑
100 44
x 2.2g
=
x=5 g
石灰石样品中碳酸钙的质量分数:
ⅹ100%=≈66.7%
答:该石灰石样品中碳酸钙的质量分数66.7%;
故答案为:(1)Zn+2HCl═ZnCl2 +H2↑;盐酸具有挥发性; C;
(2)2KMnO4
K2MnO4 +MnO2 +O2↑;
(3)①b;②紫色石蕊试液;
(4)该石灰石样品中碳酸钙的质量分数66.7%.
(2)A装置是加热固体制取气体,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,氧气密度比空气大,可用向上排空气法收集,方程式是2KMnO4
| ||
(3)①从图中可以看出Ⅱ中进气管短,说明生成的气体的密度要小于空气的密度.b中所制取的氢气密度小于空气的密度,所以选b;
②二氧化碳溶于水后形成碳酸,碳酸可使紫色石蕊试液变红.我们可利用这一性质检验二氧化碳与水的反应;
(4)由图象可知:7.5g石灰石样品与稀盐酸反应最多制取二氧化碳气体2.2g;
设7.5克石灰石中碳酸钙的质量为x
CaCO3 +2HCl═CaCl2 +H2O+CO2↑
100 44
x 2.2g
| 100 |
| 44 |
| x |
| 2.2g |
x=5 g
石灰石样品中碳酸钙的质量分数:
| 5g |
| 7.5g |
答:该石灰石样品中碳酸钙的质量分数66.7%;
故答案为:(1)Zn+2HCl═ZnCl2 +H2↑;盐酸具有挥发性; C;
(2)2KMnO4
| ||
(3)①b;②紫色石蕊试液;
(4)该石灰石样品中碳酸钙的质量分数66.7%.
点评:本题能综合考查学生对实验室制取氢气、氧气、二氧化碳知识的掌握和应用情况,既考查了相关实验知识,又考查了方程式的基本计算,是一道培养学生思维能力的不错的题目.

练习册系列答案
相关题目



 装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.
装置进行“排空气法”收集制取的CO2,请把图中的“导气管”补画完整.