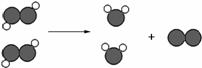
题目内容
实验室用过量的稀盐酸 和大理石制取CO2,取50 g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如右图所示。
和大理石制取CO2,取50 g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如右图所示。
回答下列问题:
(1)从图中看出生成沉淀的最大质量是____g。
(2)开始加入碳酸钠溶液至10 g时,还没有沉淀的原因是__ _。
(3)计算原滤液中氯化钙的质量分数。
5 稀盐酸先与碳酸钠反应_
解:设原滤液中CaCl2的质量为x
Na2CO3+CaCl2===CaCO3↓+2NaCl
111 100
x 5 g
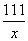 =
=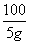 x=5.55 g
x=5.55 g
原溶液中CaCl2=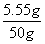 ×100%=11.1%
×100%=11.1%
答:略

以下事实对应的解释错误的是( )
| 序号 | 事实 | 解释 |
| A | 在花园中可闻到花香 | 分子在不断运动 |
| B | 用肉眼不能直接观察到CO2分子 | CO2分子很小 |
| C | 50毫升水与50毫升乙醇混合,混合后总体积小于100毫升 | 分子之间有间隔 |
| D | 冰受热变为水,水受热变为水蒸气 | 分子可以再分 |
研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
| 序号 | 实验 | 现象 |
| A | 将氢氧化钠固体放在表面皿上,放置一会儿 | 固体受潮,逐渐溶解 |
| B | 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 | 溶液变红 |
| C | 向盛有氢氧化钠溶液的试管中滴加稀盐酸 | 有氯化钠生成 |
| D | 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 | 产生蓝色沉淀 |
请回忆你和老师共同完成的酸和碱反应的实验探究,并按下列要求进行实验的设计与分析:
【实验探究】(1)请你依据下图设计一个酸和碱反应的探究实验:
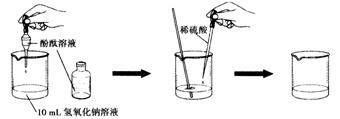
| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10 mL氢氧化钠溶液,并滴入几滴酚酞溶液 ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液 | ①溶液颜色变成_ _; ②不断搅拌溶液至溶液颜色恰好变成_ _为止。 | 酸和碱发生了中和反应,该反应属于四种基本反应类型中的_ _反应 |
(2)我选取BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中的硫酸是否过量,请你根据下表帮我判断正确的实验方案及其分析方案错误 的原因:
的原因:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白 | |
| 色沉淀 | 硫酸过量 | ||
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液 | |
| 不变色 | 酸、碱恰 | ||
| 好反应 | |||
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
【实验评价】①设计的三个方案中,有一个正确的方案是:方案_ _。
②请分析另外两个方案,错误的原因:
一个方案错误的原因是_ _;
另一方案错误的原因是_ _。
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂_ _。
 )
)