题目内容
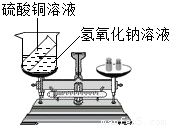
有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应,再把烧杯放到天平上,观察天平是否平衡.
你以为上述实验设计是否严密?请说明理由.

答案:
解析:
提示:
解析:
|
答案:不严密,因为氢氧化钠能与空气中的二氧化碳反应而使溶液质量增加. 精析:要验证质量守恒定律必须在密闭容器中进行,或敞口容器中无气体逸出和不与空气中所有物质反应,才能保持反应前后容器中物质的总质量相等.本题实验设计中所用药品中有氢氧化钠溶液,它会吸收空气中的二氧化碳而导致天平不平衡. |
提示:
|
说明:本题属于科学探究开放性试题,解题关键是分析敞口容器中物质总质量是否增加或减少. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 请你参与某学习小组的探究活动,并回答相关问题.
请你参与某学习小组的探究活动,并回答相关问题.
某化学兴趣小组的同学把氢氧化钠的片状固体放在表面皿中,离开实验室,一天后进行观察.
【发现问题】原来的片状固体变成了白色粉末状固体了.
【提出问题】白色粉末状固体物质是什么?
【建立假设】______.
[设计实验]请你来完成以下实验,把相关内容填写在表格中
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| ______ | 有气泡产生 | ______ |
(1)有人分析,该白色粉末也有可能为______.
(2)氢氧化钠固体露置在空气中一段时间后,发生了潮解,这个现象说明了空气中含有______,
(3)有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应再把烧杯放到天平上,观察天平是否平衡.你认为上述实设计是否严密?______,请说明理由______.
(4)将部分变质的氢氧化钠全部变为氢氧化钠的化学反应方程式______.
(5)将20g不纯的氢氧化钠固体样品(杂质不溶于水也不参加反应)与一定量的稀硫酸恰好完全反应,最终得到溶质质量分数为10%的溶液142g.求:
(1)样品中氢氧化钠的质量;
(2)加入的稀硫酸的溶质质量分数.
请你参与某学习小组的探究活动,并回答相关问题.
某化学兴趣小组的同学把氢氧化钠的片状固体放在表面皿中,离开实验室,一天后进行观察.
【发现问题】原来的片状固体变成了白色粉末状固体了.
【提出问题】白色粉末状固体物质是什么?
【建立假设】______.
[设计实验]请你来完成以下实验,把相关内容填写在表格中
【反思与思考】
(1)有人分析,该白色粉末也有可能为______.
(2)氢氧化钠固体露置在空气中一段时间后,发生了潮解,这个现象说明了空气中含有______,
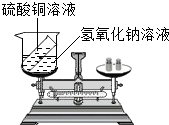
(3)有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应再把烧杯放到天平上,观察天平是否平衡.你认为上述实设计是否严密?______,请说明理由______.
(4)将部分变质的氢氧化钠全部变为氢氧化钠的化学反应方程式______.
(5)将20g不纯的氢氧化钠固体样品(杂质不溶于水也不参加反应)与一定量的稀硫酸恰好完全反应,最终得到溶质质量分数为10%的溶液142g.求:
(1)样品中氢氧化钠的质量;
(2)加入的稀硫酸的溶质质量分数.
某化学兴趣小组的同学把氢氧化钠的片状固体放在表面皿中,离开实验室,一天后进行观察.
【发现问题】原来的片状固体变成了白色粉末状固体了.
【提出问题】白色粉末状固体物质是什么?
【建立假设】______.
[设计实验]请你来完成以下实验,把相关内容填写在表格中
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| ______ | 有气泡产生 | ______ |
(1)有人分析,该白色粉末也有可能为______.
(2)氢氧化钠固体露置在空气中一段时间后,发生了潮解,这个现象说明了空气中含有______,
(3)有人设计如图所示的实验来验证质量守恒定律:把装有硫酸铜溶液的小试管放入盛有氢氧化钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡.取下烧杯并将其倾斜,使两种溶液混合反应再把烧杯放到天平上,观察天平是否平衡.你认为上述实设计是否严密?______,请说明理由______.
(4)将部分变质的氢氧化钠全部变为氢氧化钠的化学反应方程式______.
(5)将20g不纯的氢氧化钠固体样品(杂质不溶于水也不参加反应)与一定量的稀硫酸恰好完全反应,最终得到溶质质量分数为10%的溶液142g.求:
(1)样品中氢氧化钠的质量;
(2)加入的稀硫酸的溶质质量分数.

 (2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.
(2013?盐城二模)请你参与某学习小组的探究活动,并回答相关问题.