题目内容
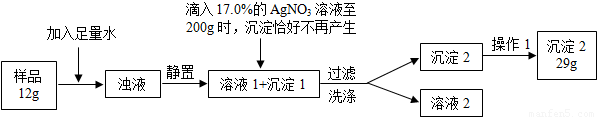
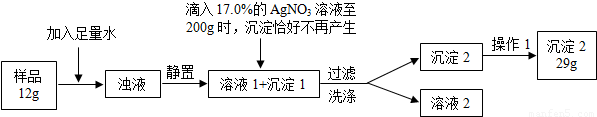
普通食盐的主要成份是NaCl和杂质,假设杂质不溶于水、受热不分解、与AgNO3不反应。王华同学测定普通食盐样品中氯化钠的质量分数时所进行的实验操作流程和实验数据如下图所示。

(实验中发生的化学反应方程式为:AgNO3 + NaCl =" AgCl↓+" NaNO3)
请你完成空格和计算:
⑴王华进行操作1的目的是 _;
⑵求算样品中氯化钠的质量分数。(结果保留小数点后1位)
【答案】
⑴干燥沉淀2 ⑵97.5%。
【解析】
试题分析:⑴由于过滤后的沉淀表面潮湿,故需干燥处理。
⑵根据题意,滴入17.0%的AgNO3溶液200g后,沉淀恰好不再产生,说明二者恰好完全反应,根据AgNO3的质量(200g×17.0%=34.0g),结合题给的反应方程式,即可计算出样品中氯化钠的质量,进一步计算样品中氯化钠的质量分数。
解:设样品中氯化钠的质量为x
AgNO3 + NaCl =" AgCl↓" + NaNO3
170 58.5
34.0g x
170:58.5=34.0g:x,
解得:x=11.7g
则样品中氯化钠的质量分数= ×100%=97.5%
×100%=97.5%
答:样品中氯化钠的质量分数为97.5%。
考点:根据化学反应方程式的计算
点评:本题为根据化学方程式计算类问题中的简单计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目


 钠的质量分数。(结果保留小数点后1位)
钠的质量分数。(结果保留小数点后1位)