题目内容
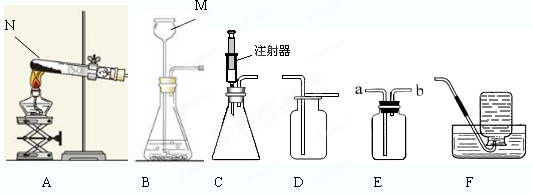
(15分)下图所示为实验室中常见的气体制备和收集装置。

请回答下列问题:
(1)请写出图中标号仪器的名称:M ;N 。
(2)实验室用高锰酸钾制取氧气,应选用的发生装置是 (填字母序号),实验时该装置试管口应放一团棉花,其目的是 ;反应的化学方程式为 ,其反应类型为: 反应。若用装置D收集氧气,验满的方法是 。
(3)实验室用H2O2溶液和MnO2制取氧气,若选用C做发生装置,你认为选用C的优点是 。在该反应过程中MnO2
起 作用。
(4)欲使用装置E用排空气法收集二氧化碳,则气体应从 (填“a”或“b”)端通入;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从 (填“a”或“b”)端通入。
(5)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置 (填字母序号)。
(6)实验室用锌与稀硫酸反应制取氢气,应选用的发生装置是 ,收集装置是 (填字母序号),反应的化学方程式为 。
(1)M 长颈漏斗(1分) N 试管(1分)
(2)A(1分) 2KMnO4 K2MnO4 +MnO2+ O2↑(1分) 分解(1分) 防止加热时高锰酸钾粉末进入导气管 将带火星的木条置于集气瓶口,木条复燃,证明已验满
K2MnO4 +MnO2+ O2↑(1分) 分解(1分) 防止加热时高锰酸钾粉末进入导气管 将带火星的木条置于集气瓶口,木条复燃,证明已验满
(3)控制氧气产生的快慢和量的多少 催化 (4)a b
(5)F (6)B或C F Zn+H2SO4=ZnSO4+H2↑
【解析】
试题分析:(1)图中标号仪器的名称:M:长颈漏斗;N:试管。
(2)实验室用高锰酸钾制取氧气,是加热固体制取气体,应选用的发生装置是A,实验时该装置试管口应放一团棉花,其目的是防止加热时高锰酸钾粉末进入导气管;反应的化学方程式为2KMnO4 K2MnO4 +MnO2+ O2↑,其反应类型为:分解反应。若用装置D收集氧气,验满的方法是将带火星的木条置于集气瓶口,木条复燃,证明已验满。
K2MnO4 +MnO2+ O2↑,其反应类型为:分解反应。若用装置D收集氧气,验满的方法是将带火星的木条置于集气瓶口,木条复燃,证明已验满。
(3)实验室用H2O2溶液和MnO2制取氧气,若选用C做发生装置,则 C的优点是可以控制氧气产生的快慢和量的多少。在该反应过程中MnO2起催化作用。
(4)欲使用装置E用排空气法收集二氧化碳,则气体应从a端通入,因为二氧化碳密度大于空气;欲使用装置E用排水法收集氧气,先将瓶中装满水,再将气体从b端通入。
(5)已知一氧化氮气体难溶于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置F,即排水集气法。
(6)实验室用锌与稀硫酸反应制取氢气,是固体和液体反应,不要加热,应选用的发生装置是B或C,收集装置是F,因为氢气难溶于水,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。
考点:常见仪器的名称;实验室制取氧气和二氧化碳的反应原理、实验装置;气体的收集方法;化学方程式的书写。
点评:氧气和二氧化碳是重要的知识点,将这两种气体放在一起对比学习,有利于对知识的理解和掌握。
实验室选择制取和收集气体的装置,要根据反应物的状体、反应条件、气体的性质等综合考虑装置的选择。
书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。

 名校课堂系列答案
名校课堂系列答案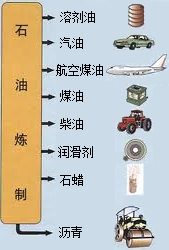 中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).
中国石油天然气集团公司近日宣布,在渤海湾滩海地区发现储量规模达十亿吨的大油田--冀东南堡油田.这对增强我国能源安全供应的保障能力具有重要意义.石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用(如图).(1)石油属于
(2)汽油是石油炼制的产品之一,直接作为燃料使用易造成环境污染.在汽油中加入适量乙醇,可节省石油资源,减少汽车尾气污染.写出乙醇在空气中燃烧的化学方程式:
(3)石油炼制的产品之一石蜡可用于制作蜡烛.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管口抽气.一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.实验数据见下表.(相对原子质量:H-1 C-12 O-16)
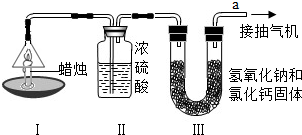
| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |
②由该实验数据计算,蜡烛中碳、氢元素的质量之比为
③装置Ⅱ和装置Ⅲ的顺序能否颠倒?
④理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是
⑤该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?

 已知空气的主要成分是氮气和氧气.某课外活动小组设计了测定空气中氧气含量的实验,实验装置如下图所示:
已知空气的主要成分是氮气和氧气.某课外活动小组设计了测定空气中氧气含量的实验,实验装置如下图所示: