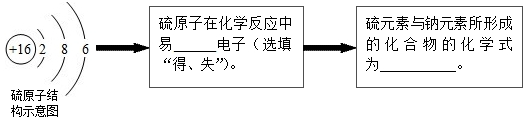
题目内容
若将50g 18%的NaOH溶液和50g 18%的盐酸混和,下列叙述正确的是( )
| A.混合溶液的pH<7 |
| B.混合溶液的质量为100g |
| C.溶液混合前后的温度不变 |
| D.混合溶液中生成物的溶质质量分数仍为18% |
A、由 NaOH+HCl═NaCl+H2O 可知,氢氧化钠、盐酸、氯化钠、水的质量比是:40:36.5:58.5:18.
即相同质量的HCl和NaOH反应时,NaOH完全反应,而酸剩余所以溶液的pH<7,故A正确;
B、反应中没有产生气体和沉淀,所以混合后的溶液仍为100g,故B正确;
C、该反应中要放出热量,所以混合后的溶液的温度要升高,故C错误;
设20g18%的NaOH溶液完全反应生成的氯化钠的质量为x.
NaOH+HCl═NaCl+H2O
40 58.5
x
=
解得:x=13g
生成氯化钠的质量分数为:
×100%=13%
而盐酸虽有剩余,但是由于被消耗一部分,所以其溶质的质量分数也小于18%,
故D错误.
故选AB.
即相同质量的HCl和NaOH反应时,NaOH完全反应,而酸剩余所以溶液的pH<7,故A正确;
B、反应中没有产生气体和沉淀,所以混合后的溶液仍为100g,故B正确;
C、该反应中要放出热量,所以混合后的溶液的温度要升高,故C错误;
设20g18%的NaOH溶液完全反应生成的氯化钠的质量为x.
NaOH+HCl═NaCl+H2O
40 58.5
x
| 40 |
| 9g |
| 58.5 |
| x |
解得:x=13g
生成氯化钠的质量分数为:
| 13g |
| 100g |
而盐酸虽有剩余,但是由于被消耗一部分,所以其溶质的质量分数也小于18%,
故D错误.
故选AB.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
 18、右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.
18、右图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题. Ⅰ右图为A、B、C三种物质的溶解度曲线,据图回答:
Ⅰ右图为A、B、C三种物质的溶解度曲线,据图回答: ,该粒子所属元素位于周期表的第
,该粒子所属元素位于周期表的第