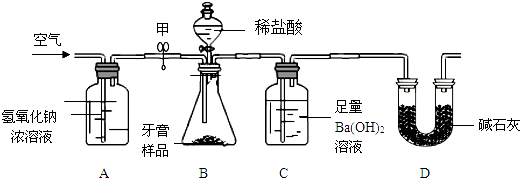
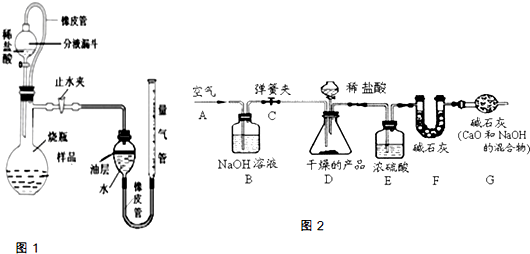
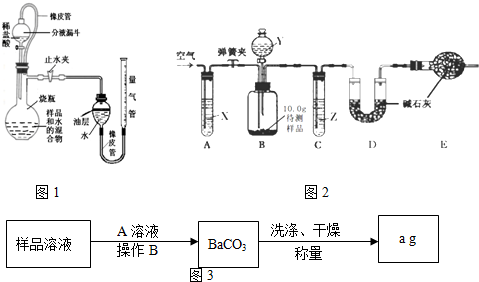
题目内容
31、氢氧化钠溶液可以使无色酚酞试液变红.我们已经知道,在氢氧化钠溶液中存在H2O分子、Na+离子和OH-离子.请你设计一个简单实验研究下面的问题:可能是氢氧化钠溶液中的哪一种粒子使无色酚酞试液变红?(写出简要的实验步骤、观察到的现象以及由此得出的结论).
分析:用排除法分别排除H2O分子、Na+离子和OH-离子三种粒子中的H2O分子、Na+离子,从而得出结论.
解答:解:设计时要分别准备只含有三种粒子中一种的物质,分别加入无色酚酞试液,看哪种粒子能使之变红,从而得出准确结论.蒸馏水中只含有水分子,氯化钠溶液中只含有三种中的钠离子,用这两种物质排除了H2O分子、Na+离子即可.
故答案为:用两支试管分别取少量蒸馏水和氯化钠溶液,各滴加紫色的石蕊试液,均不变色,说明水分子和钠离子均不能使紫色石蕊试液变红.因此可能是NaOH溶液中的OH-离子使石蕊试液变红(或其他正确答案).
故答案为:用两支试管分别取少量蒸馏水和氯化钠溶液,各滴加紫色的石蕊试液,均不变色,说明水分子和钠离子均不能使紫色石蕊试液变红.因此可能是NaOH溶液中的OH-离子使石蕊试液变红(或其他正确答案).
点评:实验方案的设计,是素质教育对化学实验教学的能力培养目标之一,而能力的考查又逐渐成了中考重点和热点,但是,该内容也是学习难点,应重点练习,养成对实验进行评价我自我设计实验的习惯.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目