题目内容
【题目】元素周期表是学习化学的重要工具。下面是元素周期表中1~18号元素原子核外电子排布,我们对它进行研究:
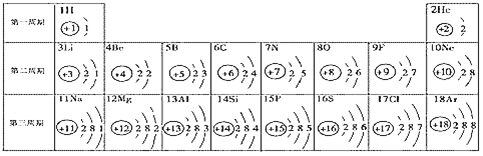
⑴第16号元素属于________元素(填“金属”或“非金属”),它在化学反应中容易________ (填“得”或“失”)电子;
⑵元素的化学性质与原子结构中的________数关系密切;
⑶在同一族中,各元素的原子结构呈现的规律有________(任写一点);
⑷研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是________。
【答案】⑴ 非金属 ;得 ; ⑵ 最外层电子 ;
⑶ 电子层数递增或最外层电子数相等或从上到下核电荷数增大等(只要合理均可)⑷ 逐渐减小
【解析】
试题(1)根据原子最外层电子数的特点分析,非金属元素的原子最外层电子的数目一般多于4个,在化学反应中容易得到电子达到稳定结构;金属元素的原子最外层电子的数目一般少于4个,在化学反应中容易失去电子达到稳定结构,第16号元素的原子最外层电子数为6,故属于非金属元素,在化学反应中容易得到2个电子。
(2)原子核外最外层电子数少于4个,一般容易失去电子形成阳离子;原子核外最外层电子数多于4个的,一般容易得到电子形成阴离子;原子核外最外层电子数为8个(只有一层的有2个电子)的,化学性质一般比较稳定,不容易发生化学变化,故元素的化学性质与原子核外的最外层电子数有密切关系。
(3)根据元素周期表分析,在同一族中(一竖行),从上到下核电荷数依次增大,各元素的原子的电子层数依次递增,但最外层电子数相等。
(4)根据题意,同一周期中,“核电荷数逐渐增大,核对核外电子的引力逐渐增大,原子半径逐渐减小”,所以从11~17号元素原子半径也是逐渐减小。

 阅读快车系列答案
阅读快车系列答案【题目】钛酸锂Li4Ti5O12是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程图如下(已知氨水是氨气的水溶液,受热时会加快氨气的挥发):
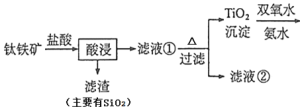
(1)在“酸浸”实验中,除了发生反应FeTiO3 + 4HCl = FeTiOCl4 + H2O,还存在另一个化学反应,其反应方程式为______________________________。
(2)在“酸浸”实验中,铁的浸出率结果如图所示。
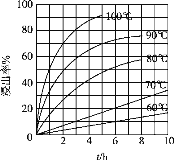
①由图分析可知,温度对浸出率的影响情况为:其它条件相同时,_______________________。
②当铁的浸出率为70%时,所采用的实验条件为______℃、_____h。
(3)TiO2沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2 转化率/% | 92 | 95 | 97 | 93 | 88 |
分析数据可知:当温度高于40℃时,TiO2转化率________(填“变大”或“变小”),请推测出现此变化的原因可能是__________。
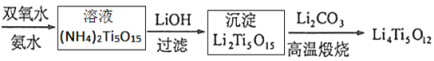
(4)当加入氢氧化锂溶液时,发生了复分解反应,该反应的化学方程式为___________。
(5)用含76kg FeTiO3的钛铁矿,理论上可以制备Li4Ti5O12的质量为________kg。




