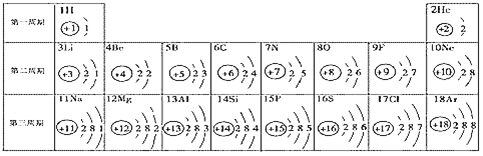
题目内容
【题目】钛酸锂Li4Ti5O12是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程图如下(已知氨水是氨气的水溶液,受热时会加快氨气的挥发):
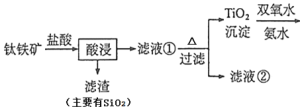
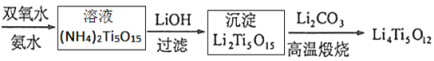
(1)在“酸浸”实验中,除了发生反应FeTiO3 + 4HCl = FeTiOCl4 + H2O,还存在另一个化学反应,其反应方程式为______________________________。
(2)在“酸浸”实验中,铁的浸出率结果如图所示。
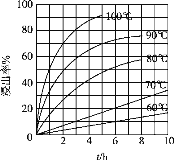
①由图分析可知,温度对浸出率的影响情况为:其它条件相同时,_______________________。
②当铁的浸出率为70%时,所采用的实验条件为______℃、_____h。
(3)TiO2沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2 转化率/% | 92 | 95 | 97 | 93 | 88 |
分析数据可知:当温度高于40℃时,TiO2转化率________(填“变大”或“变小”),请推测出现此变化的原因可能是__________。
(4)当加入氢氧化锂溶液时,发生了复分解反应,该反应的化学方程式为___________。
(5)用含76kg FeTiO3的钛铁矿,理论上可以制备Li4Ti5O12的质量为________kg。
【答案】MgO + 2HCl ==MgCl2 + H2O 温度越高,浸出率越大100℃2 h变小当温度高于40℃时,双氧水的分解和氨水的挥发使TiO2转化率变小2LiOH + (NH4)2Ti5O15 ===Li2Ti5O15↓+ 2NH3↑+ 2H2O46
【解析】
(1)钛铁矿的主要成分为FeTiO3,还含有少量MgO、SiO2等杂质,故盐酸会和氧化镁反应生成氯化镁和水,化学方程式为MgO+2HCl ==MgCl2+H2O;
(2)
①由图分析可知,温度对浸出率的影响情况为:其它条件相同时,温度越高,浸出率越大;
②由图可知,为了提高反应速率,当铁的浸出率为70%时,所采用的实验条件为100℃、2h;
(3)由表格中数据可知,当温度高于40℃时,TiO2转化率变小;出现此变化的原因可能是 当温度高于40℃时,双氧水的分解和氨水的挥发使TiO2转化率变小;
(4)由工艺流程图可知,(NH4)2Ti5O15溶液和LiOH发生复分解反应,生成Li2Ti5O15沉淀、氨气和水,化学方程式为2LiOH + (NH4)2Ti5O15 ===Li2Ti5O15↓+ 2NH3↑+ 2H2O;
(5)76kg FeTiO3中钛元素质量=76kg×![]() ×100%=24kg,Li4Ti5O12中钛元素的质量分数=
×100%=24kg,Li4Ti5O12中钛元素的质量分数=![]() =
=![]() ,根据反应前后元素质量守恒可得,Li4Ti5O12的质量=24kg÷
,根据反应前后元素质量守恒可得,Li4Ti5O12的质量=24kg÷![]() =46kg。
=46kg。