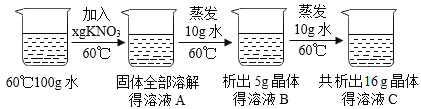
题目内容
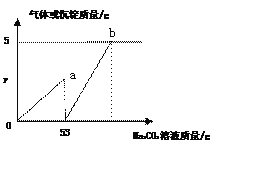
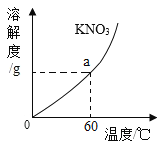
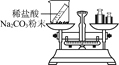
【题目】如图是A、B、C三种物质的溶解度曲线,下列分析正确的是()

A.A、B、C三种物质的溶解度都随温度的升高而增大
B.20°C时,A的饱和溶液和C的饱和溶液中含有相等质量的溶质
C.若A物质中混有少量的B,可采用降温结晶方法提纯A
D.将50°C时A、B、 C三种物质的饱和溶液降温至20°C时,这三种溶液的溶质质量分数的大小关系B> A=C
【答案】C
【解析】
A、C物质的溶解度都随温度的升高而减小,分析错误;
B、20°C时,A的饱和溶液和C的饱和溶液中不一定含有相等质量的溶质,因为饱和溶液质量不一定相等,分析错误;
C、A的溶解度受温度影响较大,若A物质中混有少量的B,可采用降温结晶方法提纯A,分析正确;
D、当温度从50°C降至20°C时,A、B两种物质的溶解度均随温度的降低而减小,分别得到20°C时A、B的饱和溶液,而C的溶解度随温度的降低而增大,则C的饱和溶液降温后,变为不饱和溶液,其溶质质量分数未发生变化,仍等于50°C时C物质的饱和溶液的溶质质量分数,20° C时B的溶解度大于A的溶解度,且大于50°C时C的溶解度,因此降温后,所得溶液溶质质量分数的大小关系是B> A>C,分析错误。
故选C。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
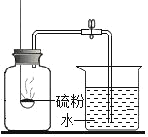
开心蛙状元作业系列答案【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】 化学反应前后各物质的质量总和是否相等?
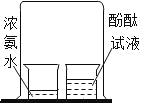
【查阅资料】 氢氧化钠溶液可以吸收二氧化碳气体
【猜想与假设】 猜想1:不相等;猜想2:相等。
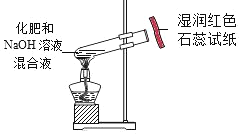
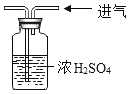
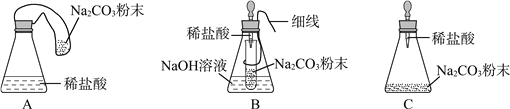
【实验探究】 甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | _________,天平指针没有偏转 |
结论 | 猜想1正确,反应的化学方程 式:_______________. | 猜想2正确 |
【反思评价】 究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_______________中进行。
【优化装置】 同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是(填序号)___,从另外两种装置中任选一种指出其不足:________。
【得出结论】 同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步
分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_________________________的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】
解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_________种元素组成。