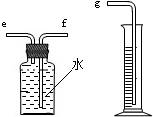
题目内容
(2013?安徽)下列实验操作正确的是( )
分析:A、根据使用胶头滴管滴加少量液体的方法进行分析判断.
B、根据取用固体药品的方法进行分析判断.
C、根据用pH试纸测定未知溶液的pH的方法进行分析判断.
D、过滤液体时,要注意“一贴、二低、三靠”的原则.
B、根据取用固体药品的方法进行分析判断.
C、根据用pH试纸测定未知溶液的pH的方法进行分析判断.
D、过滤液体时,要注意“一贴、二低、三靠”的原则.
解答:解:A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误.
B、取用固体药品时,瓶塞应倒放,图中瓶塞正放,所示操作错误.
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确.
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误.
故选C.
B、取用固体药品时,瓶塞应倒放,图中瓶塞正放,所示操作错误.
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确.
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误.
故选C.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
 (2013?安徽)铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.
(2013?安徽)铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.