题目内容
【题目】某实验小组模拟高炉炼铁的化学反应原理进行实验。其装置如下图所示,请回答下列问题。
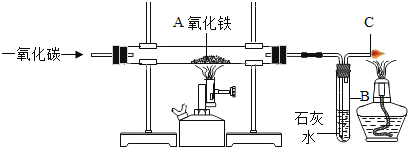
(1)A处的实验现象是_____。
(2)B处实验现象是_____。
(3)C处酒精灯的作用是_____。
(4)一种含有铁和氧化铁的混合物与16.8g一氧化碳气体恰好完全反应,其中的氧化铁全部被一氧化碳还原,最终所得固体质量为30.4g。则原混合物的质量为_____g。
【答案】红色固体变成黑色 生成白色沉淀 除去尾气中CO(或防止CO 使人中毒;防止CO污染空气;将CO 转化为没有毒性的CO2等合理答案均可) 40
【解析】
(1)在高温条件下,一氧化碳与氧化铁反应生成了了铁和二氧化碳,A处红色的氧化铁还原为黑色的铁,A处的实验现象是红色固体变成黑色;
(2)二氧化碳与氢氧化钙溶液反应生成碳酸钙白色沉淀和水,B处实验现象是生成白色沉淀;
(3)一氧化碳有毒,不能直接排放到空气中,因此要在装置图末端的导气管口放一盏燃着的酒精灯将一氧化碳燃烧除去,防止污染空气;故填:除去尾气中CO(或防止CO使人中毒;防止CO污染空气;将C0转化为没有毒性的CO2等合理答案均可);
(4)设与16.8g一氧化碳气体恰好完全反应需要氧化铁的质量为x,生成铁的质量为y

![]() x=32g
x=32g
![]() y=22.4g
y=22.4g
则原混合物中,铁的质量=30.4g﹣22.4g=8g;原混合物的质量=32g+8g=40g。

练习册系列答案
相关题目