题目内容
16.一个二氧化碳分子是由两个氧原子和一个碳原子构成的,则每个二氧化碳分子中共含有22个质子;钠原子的相对原子质量为23,核内有11个质子,则核外有11个电子.分析 一个二氧化碳分子中质子总数等于1个碳原子和2个氧原子的质子数之和,根据原子中:核电荷数=核内质子数=核外电子数、相对原子质量=质子数+中子数,结合题意进行分析解答.
解答 解:一个二氧化碳分子中质子总数等于1个碳原子和2个氧原子的质子数之和,1个碳原子核内有6个质子,1个氧原子核内有8个质子,则一个二氧化碳分子中含有6+8×2=22个质子.因为原子中:核电荷数=核内质子数=核外电子数,由题意质子数为11,故该原子的核电荷数和核外电子数均为11;故填:22;11.
点评 本题难度不大,解题的关键是掌握并灵活运用原子中核电荷数=核内质子数=核外电子数、相对原子质量=质子数+中子数.

练习册系列答案
相关题目
2.由下面实验现象可知,黑色粉末可能是( )


| A. | Fe3O4和C | B. | Fe和CuO | C. | MnO2和CuO | D. | CuO和C |
3.下列变化一定属于化学变化的是( )
| A. | 熔化 | B. | 腐烂 | C. | 爆炸 | D. | 变色 |
4.下列哪种试剂能鉴别出氯化钡、碳酸钠和氯化钠三种无色稀溶液( )
| A. | 澄清的石灰水 | B. | 稀盐酸 | C. | 稀硫酸 | D. | 硝酸银溶液 |
8.托盘天平的两边各放入等质量的烧杯,且都加入100g质量分数为9.8%的稀硫酸,天平平衡,使天平重新达到平衡,可分别往两烧杯中加入( )
| A. | 镁2g,铝2 g | B. | 镁4 g,铁、锌混合物4 g | ||
| C. | 锌5.6 g,铁5.6 g | D. | 锌6.5g,镁、铝混合物6.5g |
5.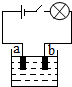 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
(1)此实验可知,上述物质中属于非电解质的是蔗糖.
(2)老师告诉小李同学,用上述装置实验,电解质溶液在导电的同时,在电极a、电极b上都会有新的物质生成.据此判断,这是一种将电能转变为化学 能的装置.
(3)阅资料得知,电解质能导电,是由于在水溶液里或熔化状态下产生自由移动的离子,这
些阴、阳离子在电流的作用下定向移动.如氯化钠在水溶液里会产生能自由移动的Na+和
Cl-,当闭合开关后,Cl-离子会由b向a方向移动.
(4)进一步查阅资料得知,一定量溶液中的阴、阳离子越多,溶液的导电性就越好.据此判断,当闭合开关后,向盛有硫酸铜溶液的烧杯中持续滴加氢氧化钡溶液时,灯泡的亮度会如何变化?先变暗直至熄灭后逐渐变亮.
 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐 NaCL | 硝酸钾 KNO3 | 蔗糖 C12H22O11 | 氢氧化钠 NaOH | 硫酸铜 CuSO4 |
| 固态 | × | × | × | × | × |
| 溶化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
(2)老师告诉小李同学,用上述装置实验,电解质溶液在导电的同时,在电极a、电极b上都会有新的物质生成.据此判断,这是一种将电能转变为化学 能的装置.
(3)阅资料得知,电解质能导电,是由于在水溶液里或熔化状态下产生自由移动的离子,这
些阴、阳离子在电流的作用下定向移动.如氯化钠在水溶液里会产生能自由移动的Na+和
Cl-,当闭合开关后,Cl-离子会由b向a方向移动.
(4)进一步查阅资料得知,一定量溶液中的阴、阳离子越多,溶液的导电性就越好.据此判断,当闭合开关后,向盛有硫酸铜溶液的烧杯中持续滴加氢氧化钡溶液时,灯泡的亮度会如何变化?先变暗直至熄灭后逐渐变亮.