题目内容
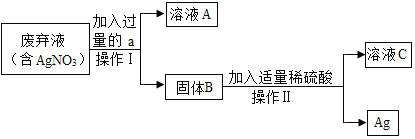
【题目】已知,氧化铜与盐酸反应程成有色溶液,现有一包固体粉末,只可能含有氧化铜、碳、铝、铁、铜中的一种或几种。取适量样品进行分析,流程和实验现象如下图。请回答相关问题:

(1)操作a在名称是___________,操作时需要的玻璃仪器烧杯、玻璃棒和___________。
(2)向样品中加过量稀盐酸有气体产生,发生反应的化学方程式为___________。
(3)向固体A中加入硝酸银溶液,发生反应的化学方程式为____________。
(4)分析结果:这包固体粉末一定含有的物质是________(写化学式)。
【答案】过滤 漏斗 2Al+6HCl=2AlCl3+3H2↑ Cu+2AgNO3=Cu(NO3)2+2Ag Al、Cu、C
【解析】
氧化铜可与盐酸反应生成蓝色的氯化铜和水,铝、铁会与盐酸反应生成氢气,碳、铜不会与盐酸反应,氯化亚铁溶液是浅绿色,样品中加入稀盐酸,得到无色溶液和气体A,所以样品中一定不含氧化铜、铁,一定含有铝,固体A和硝酸银反应生成蓝色溶液和固体B,所以A中含有铜,B在空气中灼烧会生成能使澄清石灰水变浑浊的气体,所以B中含有碳,
(1)过滤可以将不溶性固体从溶液中分离出来,所以操作a的名称是过滤,操作时需要的玻璃仪器有烧杯、玻璃棒和漏斗;
(2)向样品中加过量稀盐酸有气体产生,发生的反应是铝和盐酸反应生成氯化铝和氢气,化学方程式为:2Al+6HCl=2AlCl3+3H2↑;
(3)向固体A中加入硝酸银溶液,发生的反应是铜和硝酸银反应生成硝酸铜和银,化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)分析结果:这包固体粉末中一定含有的物质是Al、Cu、C。

【题目】将一定质量的a、b、c、d四中物质放入一密闭容器中,.在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法正确的是
物质 | a | b | c | d |
反应前质量/g | 6.40 | 3.20 | 4.00 | 0.50 |
反应后质量/g | 待测 | 2.56 | 7.20 | 0.50 |
A. a和b是反应物,d是催化剂
B. 反应后a物质的质量为4.64g
C. 物质中元素的种类,和a、b两种物质中元素的种类不同
D. 若a物质与b物质的相对分子质量之比为2:1 ,则反应汇总a和b的化学计量数之比一定是2:1
【题目】根据表中信息,填写与化学符号或符号意义相对应的①~④空格:
化学符号 | 2O2 | ②__________ | 3Mg2+ | ④____________ |
符号的意义 | ①________ | 氯原子 | ③________ | 三氧化硫中硫元素的化合价为+6价 |