题目内容
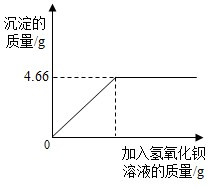 对化肥的销售,国家规定了明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示.(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2═BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
对化肥的销售,国家规定了明确的质量要求.某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应.产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示.(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2═BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?| XX牌钾肥 主要成分:K2SO4((K2SO4含量≥86%) 净重:50Kg XX化工有限公司 分析:由标签可知化肥K2SO4含量≥86%,要判断该化肥是否符合包装说明,只要算出4.0g化肥样品中K2SO4的质量分数即可.K2SO4与氢氧化钡发生了如下反应:Ba(OH)2+K2SO4=BaSO4↓+2KOH.读图可知,生成沉淀的质量为4.66g,作为已知量,根据化学方程式可计算出K2SO4的质量,进一步算出化肥的质量分数,与86%比较. 解答:解:①设--------设4.0g钾肥样品中含有硫酸钾的质量为x ②写--------Ba(OH)2+K2SO4=BaSO4↓+2KOH ③找------------------174 233 X 4.66g ④列-------
⑤解--------解得:X=3.48g 则这种钾肥样品中硫酸钾的质量分数为:
由于87%>86%,该钾肥中硫酸钾的质量分数符合产品包装说明. ⑥答:该钾肥中硫酸钾的质量分数为87%,该产品符合包装说明. 点评:该题属于标签图象型计算题,主要考查读图能力,注意解题的格式要规范. 
练习册系列答案
相关题目
对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0 g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如图所示。通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?[假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2===BaSO4↓+2KOH]
|

