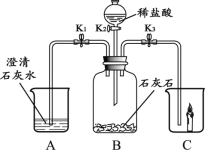
题目内容
【题目】下表是NaCl和KNO3物质在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:
温度(℃) | 10 | 20 | 30 | 40 | 60 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 110 |
(1)20℃时,NaCl的溶解度是_____g/100g水;
(2)以上两种物质溶解度变化受温度影响较小的是_____(选填“NaCl”或“KNO3”);
(3)20℃时,将20gNaCl固体加入50g水中,充分搅拌,形成的溶液质量为_____g;
(4)为了将混有少量NaCl杂质的KNO3的饱和溶液提纯,可通过_____方法获得较纯净的KNO3晶体;
(5)40℃时,将NaCl和KNO3的饱和溶液各100g降温到20℃,对剩余溶液描述正确的是_____。
A 溶质的质量分数:NaCl<KNO3
B 析出固体的质量:NaCl>KNO3
C NaCl和KNO3都是饱和溶液
D 溶剂的质量:NaCl>KNO3
【答案】36 ![]() 68 冷却结晶 CD
68 冷却结晶 CD
【解析】
(1)由表中数据可知,20℃时,![]() 的溶解度是36g/100g水;
的溶解度是36g/100g水;
(2)由表中数据可知,![]() 的溶解度随温度变化而变化不大,故溶解度变化受温度影响较小的是
的溶解度随温度变化而变化不大,故溶解度变化受温度影响较小的是![]() ;
;
(3)20℃时,![]() 的溶解度是36g/100g水,50g水最多能溶解18g
的溶解度是36g/100g水,50g水最多能溶解18g ![]() ,将20g
,将20g ![]() 固体加入50g水中,充分搅拌,形成的溶液质量为50g+18g=68g;
固体加入50g水中,充分搅拌,形成的溶液质量为50g+18g=68g;
(4)为了将混有少量![]() 杂质的
杂质的![]() 的饱和溶液提纯,可通过冷却结晶方法获得较纯净的
的饱和溶液提纯,可通过冷却结晶方法获得较纯净的![]() 晶体;
晶体;
(5)40℃时,100g ![]() 的饱和溶液中溶质质量为
的饱和溶液中溶质质量为![]() ,溶剂水的质量为
,溶剂水的质量为![]() ,100g
,100g![]() 的饱和溶液中溶质质量为
的饱和溶液中溶质质量为![]() ,溶剂水的质量为
,溶剂水的质量为![]() ;
;
![]() 和
和![]() 溶解度均随温度降低而降低,温度降至20℃时,所得溶液均为饱和溶液;其中
溶解度均随温度降低而降低,温度降至20℃时,所得溶液均为饱和溶液;其中![]() 溶液的溶质的质量为
溶液的溶质的质量为![]() ,
,![]() 溶液的溶质的质量为
溶液的溶质的质量为![]() ;
;
A、20℃时,![]() 溶液溶质质量分数为
溶液溶质质量分数为![]() ,
,![]() 溶液溶质质量分数为
溶液溶质质量分数为![]() ,故溶质的质量分数:
,故溶质的质量分数:![]() >
>![]() ,说法错误;
,说法错误;
B、析出![]() 固体的质量为26.8g-26.4g=0.4g,析出
固体的质量为26.8g-26.4g=0.4g,析出![]() 固体的质量为39g-19.3g=19.7g,故析出固体的质量:
固体的质量为39g-19.3g=19.7g,故析出固体的质量:![]() <
<![]() ,说法错误;
,说法错误;
C、![]() 和
和![]() 溶解度均随温度降低而降低,温度降至20℃时,
溶解度均随温度降低而降低,温度降至20℃时,![]() 和
和![]() 都是饱和溶液,说法正确;
都是饱和溶液,说法正确;
D、温度降低溶剂质量不变,与40℃时一样,溶剂的质量:![]() >
>![]() ,说法正确;
,说法正确;
故填:CD。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/ | 25 | 15 | 1 | 5 |
反应后质量/ | 11 | 未测 | 1 | 22 |
则下列表述正确的是( )
A.未测值为2B.丙可能是催化剂
C.乙全部发生了反应D.甲与乙反应的质量比为![]()
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图一)。
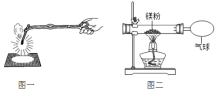
(1)请写出镁条与氧气反应的化学方程式_____________。
(2)经测量发现燃烧产物的质量_______(填“大于”“小于”或“等于”)镁条的质量,分析可知出现这一结果的原因是_________。
(3)兴趣小组按图二装置改进实验后,验证了质量守恒定律,同时发现燃烧产物中有少量黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体,常温下与水不反应;②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体为Mg3N2
(进行实验)同学们通过实验对猜想进行了验证,请你将实验记录表补充完整
实验操作 | 实验现象 | 结论 |
将镁粉燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | _______ | 黄色固体 为氮化镁 |
(反思与交流)空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,是因为 ___________。镁条_________(填“能”或“不能”)代替红磷做测定空气中氧气含量的实验,因为________________。