题目内容
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如图:
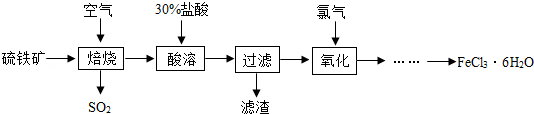
回答下列问题:
(1)焙烧就是硫铁矿燃烧,该反应化学方程式4FeS2+11O2
2Fe2O3+8X,试写出X化学式 ;硫铁矿进行燃烧之前要将其粉碎,其目的是 .
(2)流程中需用30%的盐酸“酸溶”焙烧后的残渣氧化铁.试写出其主要化学方程式 ,该反应属于 (填基本反应类型).“酸溶”时可改用硫酸吗? (填写“行”或“不行”),原因是 .
(3)实际上焙烧阶段很难做到将硫铁矿完全反应,因此酸溶后的混合物中有FeCl2,试写出FeCl2在氧化阶段与氯气(Cl2)反应生成FeCl3的化学方程式 .
(4)二氧化硫能形成酸雨,危害环境.常用用氢氧化钠溶液中吸收二氧化硫.氢氧化钠溶液的pH 7(填写“>”“=”或“<”). 写出反应的化学方程式: .

回答下列问题:
(1)焙烧就是硫铁矿燃烧,该反应化学方程式4FeS2+11O2
| ||
(2)流程中需用30%的盐酸“酸溶”焙烧后的残渣氧化铁.试写出其主要化学方程式
(3)实际上焙烧阶段很难做到将硫铁矿完全反应,因此酸溶后的混合物中有FeCl2,试写出FeCl2在氧化阶段与氯气(Cl2)反应生成FeCl3的化学方程式
(4)二氧化硫能形成酸雨,危害环境.常用用氢氧化钠溶液中吸收二氧化硫.氢氧化钠溶液的pH
考点:物质的相互转化和制备,碱的化学性质,反应类型的判定,质量守恒定律及其应用,书写化学方程式、文字表达式、电离方程式,完全燃烧与不完全燃烧
专题:物质的制备
分析:(1)根据质量守恒定律分析x,根据增大反应物的接触面积可以加快反应速率分析矿石粉碎的目的;
(2)根据氧化铁与盐酸的反应写出反应的化学方程式,根据反应的特点分析反应的类型,根据硫酸和氧化铁反应会生成硫酸铁进行分析;
(3)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
(4)氢氧化钠是一种强碱,溶液显碱性,能与二氧化硫反应,据此分析回答.
(2)根据氧化铁与盐酸的反应写出反应的化学方程式,根据反应的特点分析反应的类型,根据硫酸和氧化铁反应会生成硫酸铁进行分析;
(3)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
(4)氢氧化钠是一种强碱,溶液显碱性,能与二氧化硫反应,据此分析回答.
解答:解:(1)由质量守恒定律可知,在反应前后原子的种类和数目不变,所以,在4FeS2+11O2
2Fe2O3+8X中X化学式是SO2,增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:快速燃烧、充足燃烧;
(2)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为:2Fe2O3+6HCl═2FeCl3+3H2O,该反应由两种化合物相互交换成分生成了两种新的化合物,属于复分解反应;“酸溶”时如改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是:主产物不再是氯化铁;
(3)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为:2FeCl2+Cl2═2FeCl3;
(4)二氧化硫能形成酸雨,危害环境.常用用氢氧化钠溶液中吸收二氧化硫.氢氧化钠溶液的pH>7,反应的化学方程式:2NaOH+SO2═Na2SO3+H2O.
故答案为:(1)SO2,快速燃烧、充足燃烧;(2)2Fe2O3+6HCl═2FeCl3+3H2O,复分解反应,主产物不再是氯化铁;(3)2FeCl2+Cl2═2FeCl3;(4)>,2NaOH+SO2═Na2SO3+H2O.
| ||
(2)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为:2Fe2O3+6HCl═2FeCl3+3H2O,该反应由两种化合物相互交换成分生成了两种新的化合物,属于复分解反应;“酸溶”时如改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是:主产物不再是氯化铁;
(3)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为:2FeCl2+Cl2═2FeCl3;
(4)二氧化硫能形成酸雨,危害环境.常用用氢氧化钠溶液中吸收二氧化硫.氢氧化钠溶液的pH>7,反应的化学方程式:2NaOH+SO2═Na2SO3+H2O.
故答案为:(1)SO2,快速燃烧、充足燃烧;(2)2Fe2O3+6HCl═2FeCl3+3H2O,复分解反应,主产物不再是氯化铁;(3)2FeCl2+Cl2═2FeCl3;(4)>,2NaOH+SO2═Na2SO3+H2O.
点评:在解此类题时,首先分析题中的反应原理,然后找出对应的学过的知识点,然后结合题中所给的知识进行分析解答.

练习册系列答案
相关题目
异极矿(主要化学成分为:Zn4Si2O7(OH)2?H2O)是中国特有矿石,可制成明贵的戒指、项链等装饰品.下列关于Zn4Si2O7(OH)2?H2O的说法正确的是( )
| A、氢、氧、锌、硅四种元素的个数比为2:5:2:1 |
| B、硅元素的化合价为+6 |
| C、Zn元素的质量分数最大 |
| D、Zn4Si2O7(OH)2?H2O易溶于水 |
下列物质的化学式书写正确的是( )
| A、甲烷:CH4 |
| B、碳酸:HCO3 |
| C、碱式碳酸铜:Cu(OH)2CO3 |
| D、硝酸:NO3 |
桂花盛开,能闻到花的香味,说明( )
| A、分子很小 |
| B、分子可分 |
| C、分子之间有间隔 |
| D、分子在不停地运动 |
 图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).下列说法中错误的是( )
图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).下列说法中错误的是( )| A、甲、乙、丙可能依次为NaOH、CO2、Na2CO3 |
| B、乙物质只能是氧化物或盐 |
| C、当甲为NaOH时,它可由Ca(OH)2与Na2CO3反应生成 |
| D、乙和丙之间不可能相互转化 |
小明对某无色溶液所含溶质的记录,合理的是( )
| A、HCl、KCl、NaCl |
| B、KNO3、NaCl、CuCl2 |
| C、NaOH、K2CO3、NaCl |
| D、Ca(OH)2、Na2SO4、NH4Cl |
将下列金属放入其后的溶液中,充分作用后溶液质量比原来减轻的是( )
| A、铁片,AgNO3溶液 |
| B、铜片,稀H2SO4 |
| C、铝片,盐酸 |
| D、锌片,CuSO4溶液 |

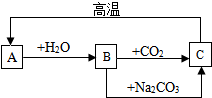 A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):