题目内容
只含铜、氧两种元素的固体样品9.0g,测得其中含铜元素的质量为8.0g.已知铜有CuO和Cu2O两种氧化物,且均为固体.下列说法不正确的是
- A.固体样品可能是Cu2O
- B.固体样品的物质成分组合只有2种情况
- C.固体样品可能是Cu、CuO与Cu2O的混合物
- D.若固体样品中只含两种物质,则两种物质的质量比可能为5:4
B
分析:A、B、C、根据已知条件计算出样品中含铜元素的质量分数,然后再分别计算出CuO和Cu2O中铜元素的质量分数,据此分析样品的组成的情况;
D、从样品的组成的情况中找出只含两种物质的情况,结合物质的化学式进行计算,即可得出两种物质的质量比.
解答:A、B、C、样品中含铜元素的质量分数为:8.0÷9.0×100%=88.9%,
CuO中铜元素的质量分数为: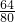 ×100%=80%,
×100%=80%,
Cu2O中铜元素的质量分数为: ×100%=88.9%(与样品一样),
×100%=88.9%(与样品一样),
所以样品的组成有三种情况:①只有Cu2O,②Cu和CuO,③Cu2O、Cu和CuO的混合物;
故AC不适合;B适合;
D、若固体样品中只含两种物质,只能是Cu和CuO,
因为其中含铜元素的质量为8.0g,则含氧元素的质量为9.0g-8.0g=1.0g,
所以CuO的质量为:1.0÷(1-80%)=5g,
单质铜的质量为:9g-5g=4g,
则两种物质的质量比为:5g:4g=5:4.
故D不适合.
故选B.
点评:本题主要考查学生运用化学式进行计算的能力.解题的关键是根据已知条件进行分析,得出样品组成的情况.
分析:A、B、C、根据已知条件计算出样品中含铜元素的质量分数,然后再分别计算出CuO和Cu2O中铜元素的质量分数,据此分析样品的组成的情况;
D、从样品的组成的情况中找出只含两种物质的情况,结合物质的化学式进行计算,即可得出两种物质的质量比.
解答:A、B、C、样品中含铜元素的质量分数为:8.0÷9.0×100%=88.9%,
CuO中铜元素的质量分数为:
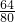 ×100%=80%,
×100%=80%,Cu2O中铜元素的质量分数为:
 ×100%=88.9%(与样品一样),
×100%=88.9%(与样品一样),所以样品的组成有三种情况:①只有Cu2O,②Cu和CuO,③Cu2O、Cu和CuO的混合物;
故AC不适合;B适合;
D、若固体样品中只含两种物质,只能是Cu和CuO,
因为其中含铜元素的质量为8.0g,则含氧元素的质量为9.0g-8.0g=1.0g,
所以CuO的质量为:1.0÷(1-80%)=5g,
单质铜的质量为:9g-5g=4g,
则两种物质的质量比为:5g:4g=5:4.
故D不适合.
故选B.
点评:本题主要考查学生运用化学式进行计算的能力.解题的关键是根据已知条件进行分析,得出样品组成的情况.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
只含铜和氧两种元素的固体样品9.0g,测得其中铜元素的质量为8.0g.已知铜的氧化物有CuO和Cu2O两种,下列说法正确的是( )
| A、样品一定是CuO | B、样品可能是Cu、CuO和Cu2O的混合物 | C、样品不可能含有Cu2O | D、样品一定是CuO和Cu2O的混合物 |
只含铜、氧两种元素的固体样品9.0克,测得其中含铜元素的质量为8.0克.已知铜的氧化物有CuO和Cu2O,下列说法正确的是( )
| A、固体样品的组成只有2种情况 | ||
| B、固体样品一定是CuO与Cu2O的混合物 | ||
| C、固体样品可能是Cu2O | ||
D、若固体样品由两种物质组成,则其中一种质量分数为
|
只含铜、氧两种元素的固体样品9.0g,测得其中含铜元素的质量为8.0g.已知铜有CuO和Cu2O两种氧化物,且均为固体.下列说法不正确的是( )
| A、固体样品可能是Cu2O | B、固体样品的物质成分组合只有2种情况 | C、固体样品可能是Cu、CuO与Cu2O的混合物 | D、若固体样品中只含两种物质,则两种物质的质量比可能为5:4 |