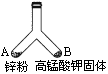
题目内容
如图所示的一个密闭叉形玻璃管,在支管A中放入mg锌粉,在支管B中放入固体KMnO4.将A、B两支管同时加热,使支管内物质都完全反应.
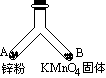
(1)写出A、B两支管内发生反应的化学方程式.
(2)若反应前后叉形管内空气成分不发生变化,则最初放入支管B的固体KMnO4是多少克?(写出计算过程,保留2位小数)
答案:
解析:
解析:
|
(1)A管:2Zn+O2 (2)若要反应前后叉形管内空气成分不发生变化,必然管内氧气质量不变,因而A管中消耗O2的质量等于B管中生成氧气的质量. ①先计算A管中消耗O2的质量.设消耗O2的质量为x,有 2Zn+O2 2×65 32 mg x 2×65∶32=mg∶x, x= ②设消耗KMnO4质量为yg 2KMnO4 2×158 32 y 2×158∶32=y∶ |

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目