题目内容
 34、如图所示,表示①和②之间发生复分解反应的有关粒子之间的变化,请写出:
34、如图所示,表示①和②之间发生复分解反应的有关粒子之间的变化,请写出:(1)①溶液中的溶质分类属于
盐
(填“酸”、“碱”、“盐”或“氧化物”),写出该溶质在水中的电离方程式Na2CO3═2Na++CO32-
;(2)由图可知①和②两溶液的反应实质是
Ca2+
和CO32-
(填微粒符号)之间的结合,反应的化学方程式为Na2CO3+Ca (OH)2═CaCO3+2NaOH
.分析:物质的分类,电离方程式的书写,复分解反应的实质.Na2CO3═2Na++CO32-
解答:解:(1)由金属阳离子和酸根离子形成的化合物称为盐(铵盐除外),溶液中溶质为碳酸钠,为盐类;据电离方程式的书写规则,写得其电离方程式为:
Na2CO3═2Na++CO32-
(2)复分解反应的条件之一为生成沉淀物,实质为阴阳离子的重新结合.
故答案为:(1)盐; Na2CO3═2Na++CO32-
(2)Ca2+; CO32-;Na2CO3+Ca (OH)2═CaCO3+2NaOH
Na2CO3═2Na++CO32-
(2)复分解反应的条件之一为生成沉淀物,实质为阴阳离子的重新结合.
故答案为:(1)盐; Na2CO3═2Na++CO32-
(2)Ca2+; CO32-;Na2CO3+Ca (OH)2═CaCO3+2NaOH
点评:本题重点考查了有关物质的分类、电离方程式的书写、复分解反应的条件和实质等知识点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 24、现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质.存在如图所示的相互反应和转化关系.图中“----”表示两端的物质间可以发生化学反应.“→”表示物质问存在相应的转化关系.
24、现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质.存在如图所示的相互反应和转化关系.图中“----”表示两端的物质间可以发生化学反应.“→”表示物质问存在相应的转化关系. 如图所示,根据氯和钾两种元素的相关信息判断,下列说法不正确的是( )
如图所示,根据氯和钾两种元素的相关信息判断,下列说法不正确的是( ) (2010?平谷区一模)A、B、C、D、E分别是初中化学常见的五种化合物,其相互反应和转化关系如图所示(“-”表示两物质能反应,“→”表示转化关系,部分生成物及反应条件已略去).其中D、E均由两种元素组成,且不含相同元素.试回答下列问题:
(2010?平谷区一模)A、B、C、D、E分别是初中化学常见的五种化合物,其相互反应和转化关系如图所示(“-”表示两物质能反应,“→”表示转化关系,部分生成物及反应条件已略去).其中D、E均由两种元素组成,且不含相同元素.试回答下列问题: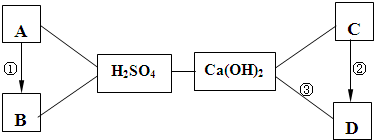 A~D是我们已经学过的四种常见物质,其中A是红色固体,D用于玻璃、造纸、纺织、洗涤剂的生产,A、B、C、D不是酸和碱,它们与稀H2SO4、Ca(OH)2之间的相互关系如图所示(“→”表示物质间的转化关系,“--”表示物质间可以相互反应),请回答下列问题:
A~D是我们已经学过的四种常见物质,其中A是红色固体,D用于玻璃、造纸、纺织、洗涤剂的生产,A、B、C、D不是酸和碱,它们与稀H2SO4、Ca(OH)2之间的相互关系如图所示(“→”表示物质间的转化关系,“--”表示物质间可以相互反应),请回答下列问题: 如图所示是表示某些粒子的示意图A、B、C、D图中的●和○分别表示两种不同元素的原子,请回答下面问题:(用A、B、C、D回答)
如图所示是表示某些粒子的示意图A、B、C、D图中的●和○分别表示两种不同元素的原子,请回答下面问题:(用A、B、C、D回答)