题目内容
氧化铜是一种黑色固体,可以溶解于稀硫酸,某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解,请你和他一起通过如图所示的1、2、3三个实验完成这次探究活动.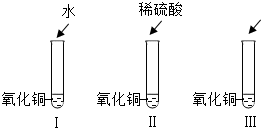
(1)是H2O使CuO溶解:你的假设是 或者是
(2)通过实验1可以证明 .
(3)要证明另外两种粒子能否溶解CuO,还需要进行实验2和3,在3中应加入的物质可以是 或 (填不同类别物质化学式).
(4)通过以上实验可知探究结果是 .
(5)你认为除实验探究2和3所用试剂外,还能够溶解CuO的一种酸(填化学式)为 .
(6)写出CuO和稀硫酸反应的化学方程式 .

(1)是H2O使CuO溶解:你的假设是
(2)通过实验1可以证明
(3)要证明另外两种粒子能否溶解CuO,还需要进行实验2和3,在3中应加入的物质可以是
(4)通过以上实验可知探究结果是
(5)你认为除实验探究2和3所用试剂外,还能够溶解CuO的一种酸(填化学式)为
(6)写出CuO和稀硫酸反应的化学方程式
考点:酸的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性
分析:由金属氧化物能与酸溶液反应生成水,不难得出氧化铜能溶于稀硫酸,是因为硫酸溶液中有氢离子的作用,抓住这一关键点就不难形成正确的思路.
解答:解:(1)假设无所谓对错,根据题给信息结合所学知识提出,故为:使氧化铜溶解的是氢离子或硫酸根离子;
(2)由于真正使氧化铜溶解的是氢离子,因此在实验1中不会看到明显的实验现象,故为:水分子不能使氧化铜溶解,
(3)因为在1、2中已经有了水分子和氢离子,在实验3中应该加入一种含有硫酸根离子的溶液,硫酸钠(或硫酸钾等)
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子;
(5)只有含有大量氢离子的溶液才可以和氧化铜反应,使之溶解,故为HCl或HNO3
(6)氧化铜与稀硫酸反应生成硫酸铜和水,反应的化学方程式为:CuO+H2SO4=CuSO4+H2O;
故答案为:(1)H+使CuO溶解;SO42-使CuO溶解
(2)水分子不能使氧化铜溶解
(3)Na2SO4;K2SO4
(4)H+使氧化铜溶解;
(5)HCl或HNO3
(6)CuO+H2SO4=CuSO4+H2O
(2)由于真正使氧化铜溶解的是氢离子,因此在实验1中不会看到明显的实验现象,故为:水分子不能使氧化铜溶解,
(3)因为在1、2中已经有了水分子和氢离子,在实验3中应该加入一种含有硫酸根离子的溶液,硫酸钠(或硫酸钾等)
(4)通过实验可以得知,水分子和硫酸根离子都不能使氧化铜溶解,使氧化铜溶解的是氢离子;
(5)只有含有大量氢离子的溶液才可以和氧化铜反应,使之溶解,故为HCl或HNO3
(6)氧化铜与稀硫酸反应生成硫酸铜和水,反应的化学方程式为:CuO+H2SO4=CuSO4+H2O;
故答案为:(1)H+使CuO溶解;SO42-使CuO溶解
(2)水分子不能使氧化铜溶解
(3)Na2SO4;K2SO4
(4)H+使氧化铜溶解;
(5)HCl或HNO3
(6)CuO+H2SO4=CuSO4+H2O
点评:主要考查了酸溶液和氧化铜反应的本质,是溶液中的氢离子和氧化铜反应的结果,培养学生分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某化学兴趣小组按以下步骤探究化肥氯化钾溶液酸碱性的强弱程度:
【猜想或假设】溶液的pH可能为(请将你的假设填入空格中):①pH<7 ② 、③
【设计和实验】用 来测定溶液酸碱性的强弱程度,步骤如下: .
【猜想或假设】溶液的pH可能为(请将你的假设填入空格中):①pH<7 ②
【设计和实验】用
A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,它们的转化关系如图所示.请回答:

(1)物质B的化学式为 ;
(2)反应①的化学方程式为 ;
(3)反应③的化学方程式为 .

(1)物质B的化学式为
(2)反应①的化学方程式为
(3)反应③的化学方程式为
相同质量的下列物质分别与足量的稀盐酸反应,生成气体最多的是( )
| A、碳酸氢钠 | B、碳酸钙 |
| C、碳酸钡 | D、碳酸钾 |
已知较活泼金属的氧化物能与水反应生成相应的碱.下列物质间的每一转化不能都通过一步反应实现的是( )
| A、CuO→Cu→CuO |
| B、O2→Fe3O4→O2 |
| C、NaOH→H2O→NaOH |
| D、Fe→FeCl2→Fe |