题目内容
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄
铜中铜的质量分数,现取20g该样品粉碎,加入到100g稀硫酸中,恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6克。
①反应生成氢气的质量是__________________,
②黄铜样品中铜的质量分数是_______________,
③计算稀硫酸中溶质的质量分数。
④所得溶液中溶质的质量。
①0.4g (1分) ②35% (1分)
③解:设稀硫酸中溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑ (1分)
98 161 2
x y 0.4
98 : x = 161:y = 2 : 0.4g
解得:x=19.6g y=32.2 (2分)
稀硫酸中的溶质的质量分数=19.6g/100g*100%=19.6% (1分)
答:略
④26.9%
【解析】①根据质量守恒定律参加反应的各物质的质量总和等于生成的各物质的质量总和,减少的质量即为氢气的质量=20g+100g-119.6g=0.4g
②解:设稀硫酸中溶质的质量为x
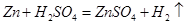
65 2
x 0.4g
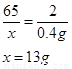
铜的质量=20g-13g=7g 铜的质量分数= 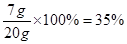
③解:设稀硫酸中溶质的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
98 161 2
x y 0.4g
98 : x = 161:y = 2 : 0.4g
解得:x=19.6g y=32.2
稀硫酸中的溶质的质量分数=19.6g/100g*100%=19.6%
④解:设硫酸锌中溶质的质量为y
Zn + H2SO4 = ZnSO4 + H2↑
161 2
y 0.4g
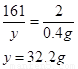
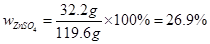

 阅读快车系列答案
阅读快车系列答案