题目内容
【题目】铝、铁、铜是生活中常见的金属。
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有______。
(2)铝在空气中不易被锈蚀,是因为______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(3)铜锈的主要成分为碱式碳酸铜Cu2(OH)2CO3,由此我们可以得到铜生锈是铜和氧气、水、______共同作用的结果。
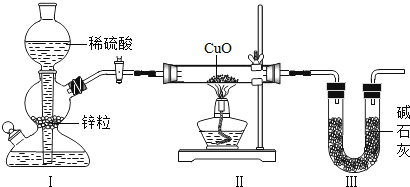
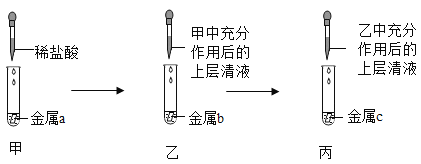
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。![]() 每步反应金属均有剩余
每步反应金属均有剩余![]() 若甲试管中无明显现象,乙试管中的金属b为______时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为______若金属a、b、c依次为铁、铝、铜时,则无法比较______和______的活动性强弱。
若甲试管中无明显现象,乙试管中的金属b为______时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为______若金属a、b、c依次为铁、铝、铜时,则无法比较______和______的活动性强弱。
【答案】导电性 ![]() 二氧化碳 铁
二氧化碳 铁 ![]() 铁 铜
铁 铜
【解析】
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有导电性。
(2)铝在空气中不易被锈蚀,是因为易被氧气氧化生成致密的氧化铝保护膜,化学方程式:4Al+3O2=2Al2O3。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],铜锈中含有铜、氢、氧和碳元素,根据质量守恒定律,由此我们可以得到铜生锈需要含有氢元素、氧元素和碳元素的物质,空气中含有氢元素的物质是水,含有碳元素的物质是二氧化碳,故是铜和氧气、水和二氧化碳共同作用的结果。
(4)金属活动性顺序为铝>铁>铜。若甲试管中无明显现象,则甲中是铜,上层清夜是盐酸,可以与铁反应生成氯化亚铁,氯化亚铁能与铝反应生成氯化铝和铁,故乙试管中的金属b为铁时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为2Al+3FeCl2=2AlCl3+3Fe;
若金属a、b、c依次为铁、铝、铜时,a中铁与盐酸反应生成氯化亚铁,氯化亚铁与b中的铝反应生成氯化铝和铁,可以证明铁和铝的活动性,铝>铁,氯化铝不与c中的铜反应,可以知道铝和铜的活动性,铝>铜,所以无法比较铁和铜的活动性强弱。

【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
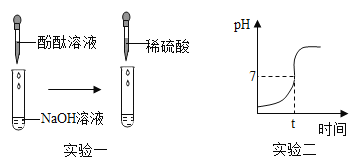
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
【题目】溶液普遍存在于生活中。通过科学探究中的控制变量法可以测得物质的溶解度。
(1)在探究固体物质溶解度时,需考虑的因素有a.溶质的种类;b.______________________;c.溶剂的温度;d.溶剂的质量;e.溶质被溶剂溶解的最大值。若要测定“某种固体物质在不同温度时的溶解度”,其研究所指的是_________________________受温度变化的影响,实验必须严格控制其它因素保持不变。
(2)下表格是根据控制变量法测得:在不同温度时,两种固体物质在水中的溶解度。
温度°C | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①从上表可知,两种物质溶解度受温度变化影响较小的是__________________。
②据上表推测,氯化钠和硝酸钾溶解度相等时温度范围在_________________。
A 10℃-20℃
B 20℃~30℃
C 30℃~40℃
③若在氯化钠中混有少量的硝酸钾,提纯氯化钠的方法是_________________。
(3)20℃时,将等质量的氯化钠、硝酸钾分别放入盛有100g水的甲、乙烧杯中,充分溶解后再升温到40℃。其实验过程如图所示:40℃时甲烧杯中的溶液状态为________________(填“饱和溶液”“不饱和溶液”或“不能确定”)。
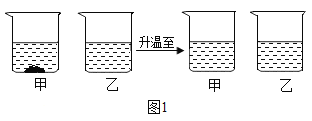
(4)乐乐同学取氯化钠、硝酸钾中的一种物质,按照下图所示进行一系列实验操作。
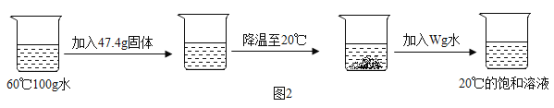
该同学所取的物质是______________________,W的数值为___________________。
(5)小明同学帮助实验员老师配制5%的氯化钠溶液80g(水的密度为1g.mL-1),正确的实验操作顺序标号为___________________。
A 用托盘天平称量4.0g的氯化钠固体
B 用托盘天平称量5.0g的氯化钠固体
C 将固体氯化钠和水在小烧杯中混合
D 将配制好的溶液装瓶,贴上标签
E 用100mL量筒量取76.0mL水
F 用200mL量筒量取75.0mL水