题目内容
相同质量的铁、锌、铝、镁分别跟足量的盐酸反应,产生氢气的质量由大到小的顺序是
[ ]
A.Zn、Fe、Mg、Al
B.Al、Fe、Mg、Zn
C.Al、Mg、Fe、Zn
D.Fe、Mg、Zn、Al
答案:C
解析:
解析:
|
如用常规解法,需设相同质量的四种金属均为1 g,根据四个化学反应方程式计算产生氢气的质量: Fe+2HCl 56 2 65 2 1 g x 1 g y x= 2Al+6HCl 2×27 3×1×2 24 2 1 g z 1 g w z= 则产生H2的质量由大到小的顺序是:Al、Mg、Fe、Zn,答案为C. 通过常规计算,我们根据四种金属产生H2的质量可发现一个规律:相同质量的金属与足量酸反应,产生H2的质量都是金属元素的化合价除以该金属的相对原子质量.所以,碰到这类题时可直接用该金属的化合价除以其相对原子质量,求得H2的质量,可免去通过化学方程式计算求解. |

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
图中是相同质量的铁、锌、铝、镁四种金属分别与足量的盐酸反应产生的氢气质量与反应时间的关系图.按铁、锌、镁、铝的顺序与图中对应正确的是
[
]
|
A .①②③④ |
B .③④②① |
|
C .①②④③ |
D .④②③① |
图中是相同质量的铁、锌、铝、镁四种金属分别与足量的盐酸反应产生的氢气质量与反应时间的关系图.按铁、锌、镁、铝的顺序与图中对应正确的是
[
]
|
A .①②③④ |
B .③④②① |
|
C .①②④③ |
D .④②③① |
 20、相同质量的铁、锌、镁、铝分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属是( )
20、相同质量的铁、锌、镁、铝分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属是( )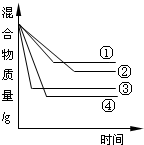 将相同质量的铁、锌、镁、铝分别加入到盛有足量盐酸的烧杯中,使其充分反应,烧杯中混合物的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属依次是( )
将相同质量的铁、锌、镁、铝分别加入到盛有足量盐酸的烧杯中,使其充分反应,烧杯中混合物的质量与反应时间的关系如图所示,图中曲线①②③④对应的金属依次是( )