题目内容
7.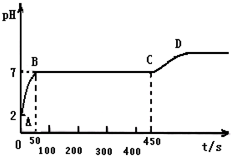 块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
块状石灰石和适量稀盐酸反应至气泡不再逸出后,测得其残留液pH 等于2.此时取反应后澄清溶液10g,逐滴匀速滴入10.6%的碳酸钠溶液,若1秒滴入0.1g碳酸钠溶液,用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:(1)若向残留液中滴加紫色石蕊试液,石蕊试液会变红;
(2)实验中,曲线B点之前澄清溶液中的离子有钙离子、钠离子,氯离子;
(3)C点时溶液中有多少白色沉淀?
(4)CD段上升的原因是碳酸钠溶液显碱性且碳酸钠溶液过量.
分析 根据测得其残留液pH等于2,说明盐酸有剩余.根据图象可知,AB段的pH越来越大,先是石灰石与稀盐酸反应生成氯化钙和水和二氧化碳,由于碳酸钠溶液呈碱性,故随着碳酸钠溶液的增加pH越来越大,BC段此时是氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,CD段是碳酸钠过量,碳酸钠溶液呈碱性解答.
解答 解:
(1)测得其残留液pH等于2,说明盐酸有剩余.若向残留液中滴加紫色石蕊试液,石蕊试液会变红;
(2)根据图象可知,AB段的pH越来越大,先是石灰石与稀盐酸反应生成氯化钙和水和二氧化碳,其反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;随着碳酸钠的增加,由于碳酸钠溶液呈碱性,故随着碳酸钠溶液的增加pH越来越大,说明是盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,其反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,当二者恰好完全反应时,溶液的pH不再变化,即BC段,实验中,曲线B点之前澄清溶液中的离子有钙离子、钠离子,氯离子;
(3)BC段是氯化钙和碳酸钠反应生成碳酸钙白色沉淀和氯化钠,其反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
消耗碳酸钠的质量为=(450s-50s)×0.1g/s×10.6%=40g×10.6%
设生成碳酸钙的质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl;
106 100
40g×10.6% x
$\frac{106}{40g×10.6%}=\frac{100}{x}$
x=4g
(4)当氯化钙和碳酸钠完全反应时,随着碳酸钠的增加,溶液的pH越来越大,故CD段是碳酸钠过量,碳酸钠溶液呈碱性.
故答案为:
(1)变红;
(2)钙离子、钠离子,氯离子;
(3)C点时溶液中有4g白色沉淀产生;
(4)碳酸钠溶液显碱性且碳酸钠溶液过量.
点评 本考点主要考查了溶液PH的变化等,综合性比较强.加强有关知识的整合,能够灵活运用.

| A. | 氢氧化钠易溶于水,溶解时放出大量的热 | |
| B. | 浓碱溶液和浓酸溶液都有强烈的腐蚀作用 | |
| C. | 所有的碱和酸都能使紫色石蕊试液变色 | |
| D. | “三酸”是盐酸、硫酸和硝酸,“两碱”是烧碱和纯碱 |
| A. | 消耗的氯化氢一样多 | B. | 碳酸镁消耗的氯化氢少 | ||
| C. | 生成的二氧化碳一样多 | D. | 碳酸氢钠生成的二氧化碳少 |
| A. | 青蒿素的相对分子质量为282 | |
| B. | 青蒿素属于有机化合物 | |
| C. | 青蒿素中含有42个原子 | |
| D. | 青蒿素中碳元素的质量分数约为63.8% |
 某校兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.
某校兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.(一)首先,他们分组进行讨论:
(1)小光小组认为,选择的药品既要能消耗氧气,又不会与空气中的其他成分反应,而且生成物为固体.他们应该选择C
A.蜡烛 B.硫粉 C.红磷
为了充分消耗容器中的氧气,药品的用量应保证红磷足量.
(2)小明小组设计了如图的两套实验装置,你认为合理的是(填序号)A.为了确保实验的成功,首先应保证该装置气密性性良好.
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
| 组 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| $\frac{集气瓶容积}{进入水的体积}$ | $\frac{20}{4}$ | $\frac{20}{3.5}$ | $\frac{20}{4}$ | $\frac{20}{4}$ | $\frac{20}{4}$ | $\frac{20}{4.5}$ | $\frac{20}{4}$ | - |




