题目内容
(2013?北京二模)碳酸钙是钙的碳酸盐化合物,工业用途甚广.
(1)石灰石用途非常广泛.可用来吸收火力发电厂煤燃烧时产生的二氧化硫废气,请将反应的化学方程式补充完整:2CaCO3+2SO2+O2
2CaSO4+
(2)电子工业高纯碳酸钙的制备.硝酸钙与碳酸铵在溶液中反应的化学方程式是:Ca(NO3)2+(NH4)2CO3=CaCO3↓+2NH4NO3,采用
(3)常用工业碳酸钙(含有少量NaCl、FeCl3等杂质)为原料生产某融雪剂.主要生产流程如图所示.已知:Fe(OH)3为难溶的碱.

①碳酸钙与盐酸反应的化学方程式是
②溶液A加入过量熟石灰的主要目的是
③固体乙的成分是
(1)石灰石用途非常广泛.可用来吸收火力发电厂煤燃烧时产生的二氧化硫废气,请将反应的化学方程式补充完整:2CaCO3+2SO2+O2
| ||
2CO2
2CO2
.(2)电子工业高纯碳酸钙的制备.硝酸钙与碳酸铵在溶液中反应的化学方程式是:Ca(NO3)2+(NH4)2CO3=CaCO3↓+2NH4NO3,采用
过滤
过滤
操作进行沉淀分离.(3)常用工业碳酸钙(含有少量NaCl、FeCl3等杂质)为原料生产某融雪剂.主要生产流程如图所示.已知:Fe(OH)3为难溶的碱.

①碳酸钙与盐酸反应的化学方程式是
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.②溶液A加入过量熟石灰的主要目的是
使FeCl3沉淀完全
使FeCl3沉淀完全
.③固体乙的成分是
CaCl2、NaCl
CaCl2、NaCl
.分析:(1)根据化学反应前后原子的种类和数目不变进行解答;
(2)根据难溶性的固体和液体分离采用过滤法;
(3)①碳酸钙与盐酸反应产生氯化钙、水和氧气,写出反应的方程式;
②根据碳酸钙中含有的杂质分析,加入过量氢氧化钙能把杂质离子沉淀出来;
③依据流程中物质反应的情况分析乙中存在的物质即可.
(2)根据难溶性的固体和液体分离采用过滤法;
(3)①碳酸钙与盐酸反应产生氯化钙、水和氧气,写出反应的方程式;
②根据碳酸钙中含有的杂质分析,加入过量氢氧化钙能把杂质离子沉淀出来;
③依据流程中物质反应的情况分析乙中存在的物质即可.
解答:解:(1)由反应的化学方程式2CaCO3+O2+2SO2═2CaSO4+X,根据化学变化前后原子的种类、数目不变,可判断生成物X的含有2个C原子和4个O原子,则每个分子由1个C原子和2个O原子构成,物质的化学式为CO2.
(2)产物碳酸钙难溶于水,硝酸铵易溶于水,因此可以采用过滤法分离;
(3)①碳酸钙与盐酸反应产生氯化钙、水和氧气,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②碳酸钙经盐酸反应后的溶液A中含有少量Fe3+杂质,加入过量的氢氧化钙和氯化铁反应产生氢氧化铁沉淀,把杂质除去;
③由变化的流程可知固体C中含有原混合物中的氯化钠,和反应过程中生成的氯化钙;
故答案为:(1)2CO2 ;(2)过滤;
(3)①CaCO3+2HCl=CaCl2+H2O+CO2↑;②使FeCl3沉淀完全;③CaCl2、NaCl.
(2)产物碳酸钙难溶于水,硝酸铵易溶于水,因此可以采用过滤法分离;
(3)①碳酸钙与盐酸反应产生氯化钙、水和氧气,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②碳酸钙经盐酸反应后的溶液A中含有少量Fe3+杂质,加入过量的氢氧化钙和氯化铁反应产生氢氧化铁沉淀,把杂质除去;
③由变化的流程可知固体C中含有原混合物中的氯化钠,和反应过程中生成的氯化钙;
故答案为:(1)2CO2 ;(2)过滤;
(3)①CaCO3+2HCl=CaCl2+H2O+CO2↑;②使FeCl3沉淀完全;③CaCl2、NaCl.
点评:此题是对与融雪相关的问题考查,涉及面广知识点较基础,质量守恒定律的运用、过滤分离混合物的原理、除杂的方法等,重点是强化基础知识的学习,能够考查同学们的综合分析能力.

练习册系列答案
相关题目
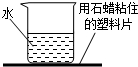 (2013?北京二模)某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )
(2013?北京二模)某同学往右图所示的烧杯(用石蜡将烧杯和塑料片粘在一起)中加入一种固体物质,搅拌后,发现石蜡熔化,塑料片掉了下来.该同学加入的物质可能是( )