题目内容
如图是A、B、C、三种物质的溶解度曲线,下列叙述正确的是( )
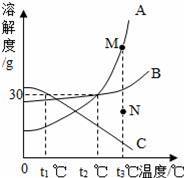

A.若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法
B.t2℃时,A、C两种物质溶液的溶质的质量分数一定相等
C.t2℃时,A、B两种物质的饱和溶液降温到t1℃,析出A的质量更大
D.t3℃时,三种物质的溶质质量分数大小顺序为A>B>C
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
【解答】解:A、t3℃时N点表示A的不饱和溶液,M点表示A的变化溶液,所以若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法,故A正确;
B、t2℃时,A、C两种物质饱和溶液的溶质的质量分数一定相等,故B错误;
C、t2℃时,A、B两种物质的饱和溶液的质量不确定,析出晶体的质量就不确定,故C错误;
D、t3℃时,三种物质的饱和溶液溶质质量分数大小顺序为:A>B>C,故D错误.
故选:A.

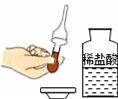
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂,因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.
(1)氢氧化钙溶液和稀盐酸反应的化学方程式: .
(2)探究烧杯内溶液中溶质的成分.
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想与假设】
猜想①:溶质是CaCl2和Ca(OH)2;
猜想②:溶质是CaCl2;
猜想③:溶质是 .
【查阅资料】氯化钙溶液呈中性.
【进行实验】
| 实验步骤 | 实验现象 | 结论 |
| 取少量烧杯内溶液于试管中,滴入几滴酚酞溶液 |
| 猜想①错误 |
| 取少量烧杯内溶液于另一支试管中,加入 |
| 猜想③正确 |
【反思】针对猜想③正确的溶液,要使其溶液中溶质只有CaCl2,应向烧杯中加入过量的 (填化学式)
【拓展】对于没有明显现象的化学变化,可以从反应物被消耗和相应生成物出现两个方面加以证明,对于本题涉及的实验,试从反应物是否被消耗的角度再设计两种方案证明反应确实发生了.
| 实验操作 | 预期实验现象 |
|
| 如果一段时间后锌粒表面有气泡冒出 |
|
| 如果一段时间后石灰石表面有气泡冒出 |

 CuCl2等.已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题:
CuCl2等.已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题:


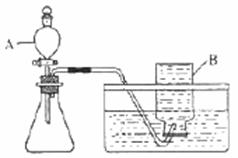
 氧气的方法叫 ,采用该方法收集的理由是 ,除此之外还可选择 法收集氧气,理由是 ,若他们采用后面这种方法收集氧气,如何检验氧气是否充满了容器?
氧气的方法叫 ,采用该方法收集的理由是 ,除此之外还可选择 法收集氧气,理由是 ,若他们采用后面这种方法收集氧气,如何检验氧气是否充满了容器?