题目内容
煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气。某工厂有含硫0.8%的煤
5000 t,回答下列问题:
① 5000 t含硫0.8%的煤中,所含硫的质量是多少
② 二氧化硫的相对分子质量为____________,上述煤如果不经处理直接完全燃烧,产生二氧化硫的质量是多少?
③ 二氧化硫可用于生产硫酸,化学方程式为2SO2+O2+2H2O==2H2SO4。参加反应的SO2与生成的H2SO4的质量比是____________,如果将上述SO2全部转化,可得到H2SO4的质量为____________t(精确到0.1)
40t 64 80t(5分) 32:49 122.5t(5分)

练习册系列答案
相关题目
将溶质质量分数为30%的硝酸钠不饱和溶液分别进行如下处理,试填溶液中各个量的变化(填“增大”“变小”或“不变”)。
| 处理方法 | 加入一些水 | 加入一些硝酸钠 | 倒出部分溶液 | 升高温度(水不蒸发) |
| 溶液质量 | ||||
| 溶剂质量 | ||||
| 溶质质量 | ||||
| 溶质质量分数 |
 组成元素相同,所以两者化学性质相同
组成元素相同,所以两者化学性质相同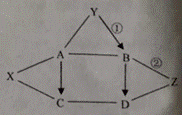 已知A、B、C、D、X、Y、Z均为初中化学常见的物质,相互关系如右图所示,“→”表示转化关系,“—”表示相互之间能反应(部分反应物、生成物以及反应条件省略)。其中,X是应用最广泛的金属;Y可用作食品干燥剂;C的溶液呈蓝色,可用于配制农药波尔多液;B、D所属物质类别相同,D俗称烧碱。请回答下列问题:
已知A、B、C、D、X、Y、Z均为初中化学常见的物质,相互关系如右图所示,“→”表示转化关系,“—”表示相互之间能反应(部分反应物、生成物以及反应条件省略)。其中,X是应用最广泛的金属;Y可用作食品干燥剂;C的溶液呈蓝色,可用于配制农药波尔多液;B、D所属物质类别相同,D俗称烧碱。请回答下列问题: