题目内容
(10分)铝、铁、铜是我们生活中常见的金属。
(1)铝制品具有很好的抗腐蚀性能,现在世界上铝的年产量已超过了铜。请将方框内横线上的正确答案填写在答题纸上。

(2)防止金属腐蚀已成为科学研究和技术领域中的重大问题。光亮的铁钉在下列几种情况下,最不容易生锈的是 (填字母序号)。

(3)某校化学实验室废液桶中收集了溶解大量FeSO4和CuSO4(是重金属污染物之一)的废水,若直接排放到下水道既造成污染又造成浪费。某化学课外小组同学运用所学化学知识对废水进行处理,并回收硫酸亚铁晶体和铜,实验方案如下:

请回答:
①X是 (写名称),将其加入废水后发生反应的化学方程式为 ;
②Y是 (写名称),利用其除去固体中的杂质,有关反应的化学方程式为 。
(1) 失 ; +3 ; Al2O3 。 (2) B
(3) ①铁;Fe +CuSO4=FeSO4 + Cu; ②硫酸,Fe + H2SO4=FeSO4 + H2↑
【解析】
试题分析:1、由铝原子结构示意图可知,铝原子最外层有3个电子,在反应中,容易失去3个电子,显+3价,铝的氧化物化学式为:Al2O3 ;
2、铁生锈是铁和氧气、水发生的复杂的化学反应,题中B图铁钉完全浸在植物油中,不与氧气和水接触,最不容易锈蚀;
3、根据题意可知,课外小组的同学要从含硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁晶体,则加入废水中的过量金属应该是铁,发生的反应为:Fe +CuSO4=FeSO4 + Cu;因加入的铁是过量的,过滤后所得的固体中除了铜外,还有铁,因此要加入稀硫酸除去铜中的铁,反应的方程式为:Fe + H2SO4=FeSO4 + H2↑。
考点:原子结构示意图;化合价;化学方程式;物质推断;除杂。
点评:本题综合性较强,难度较大。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是______(填序号).
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
(1)金属的位置越靠前它的活动性就越强;
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
(3)位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来.
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为______,由此我发现了一条新的判断依据______.
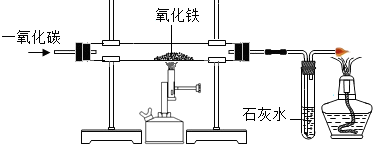
(4)炼铁的原理是利用一氧化碳与氧化铁反应.在实验室里,可用右图所示装置进行实验:实验中玻璃管内的粉末由红色变为______色,该反应的化学方程式为______,通过实验我可以得出的一氧化碳的相关化学性质是______.
(5)工业上火法炼铜的一个主要反应是 Cu2S+O2
 2Cu+SO2 Cu2S中铜元素的质量分数为______(写出算式).
2Cu+SO2 Cu2S中铜元素的质量分数为______(写出算式).用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.
