题目内容
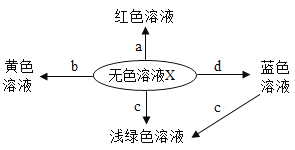
【题目】A~E为初中化学常见的物质,它们有如图所示的转化关系,图中“﹣”表示相连的物质间能相互发生反应,“→”表示物质间有相应的转化关系,其中A、B都是黑色固体,通常情况下,C是一种能使澄清石灰水变浑浊的气体,D是无色无味的液体,请回答下列问题:

(1)物质C的化学式是________;
(2)写出下列反应的化学方程式 ②__________其基本反应类型为 __________;
(3)写出由D转化为E的化学方程式____________该反应会____________(填“吸热”或“放热” )
【答案】CO2 CuO+H2 ![]() Cu+H2O(合理即可) 置换反应(合理即可) CaO+H2O=Ca(OH)2(合理即可) 放热反应
Cu+H2O(合理即可) 置换反应(合理即可) CaO+H2O=Ca(OH)2(合理即可) 放热反应
【解析】
A~E为初中化学常见的物质,A、B都是黑色固体,通常情况下,C是一种能使澄清石灰水变浑浊的气体,则C是二氧化碳,D是无色无味的液体,D可能是水;A、B会转化成二氧化碳,A能与B反应,碳在氧气中燃烧生成二氧化碳,碳能与氧化铜反应生成铜和二氧化碳,氧化铜和氢气反应生成水,A可能是碳,B可能是氧化铜;二氧化碳会与E反应,二氧化碳能与氢氧化钠、氢氧化钙反应,E可能是氢氧化钠、氢氧化钙等,经过验证,推导正确。
根据以上分析可知:
(1)C是二氧化碳,化学式为CO2;
(2)反应②可能是氧化铜和氢气在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+H2 ![]() Cu+H2O;该反应由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应;
Cu+H2O;该反应由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,属于置换反应;
(3)D转化为E可能是水和氧化钙生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2;该反应是放热反应。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】人教版新课标化学九年级上册教材中“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其效果如何?
实验步骤 | 实验现象 |
Ⅰ.分别量取 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生所泡,带火星的木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为 | |
Ⅳ.分别量取 |
(实验结论)
(1)A中产生的气体是______。
(2)实验Ⅱ、Ⅲ证明:氧化铁的______和______在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)写出氧化铁催化过氧化氢分解的文字表达式:________。
(实验评价)
(4)设计实验Ⅳ的目的是_________。
(5)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此可以得到的结论是____________。
(6)兴趣小组同学又进一步探究二氧化锰的质量对催化效果的影响。图Ⅰ是利用压强传感器研究“二氧化锰质量对过氧化氢分解产生氧气速率的影响”的实验装置。实验测得相关数据整理如图Ⅱ所示。

根据实验数据可以得出的结论是_____________。
(实验拓展)
(7)查阅资料得知:![]() 、
、![]() 、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______。
、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______。
A.![]() 只能作氧化氢溶液分解的催化剂
只能作氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其他反应的反应物或生成物
(8)你还能想到什么因素能影响过氧化氢分解的速率?请举一例说明。因素__________;实验方法:__________。