题目内容
现有一瓶质量分数为20%的某溶液,倒出
体积后再加水,直到所得溶液质量和原来溶液的质量相等,又倒出
体积,最后剩下溶液中溶质的质量分数为( )
| 3 |
| 4 |
| 2 |
| 3 |
| A、3% | B、4% | C、5% | D、6% |
分析:先对溶液倒出
体积的水时溶质的量进行计算,再根据溶液具有均一性的特征,所求的质量分数应等于第1次加水后的溶液的质量分数.
| 3 |
| 4 |
解答:解:设溶质质量分数为20%的溶液的质量为m,则倒出3/4体积后剩余溶液中溶质质量为
×m×20%,最后溶液中溶质的质量分数为
×100%=5%,根据溶液具有均一性的特征,剩余溶液的溶质质量分数与第一次加水后的相同.
故选C
| 1 |
| 4 |
| ||
| m |
故选C
点评:此题是对溶质质量分数的考查,解决的依据是找到溶液中溶质的量与溶剂的量,然后进行求解.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
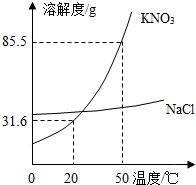 (2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.
(2013?北辰区一模)实验室欲配制一定溶质质量分数的KNO3溶液,现只有含少量NaCl的KNO3固体样品.