题目内容
【题目】实验室内,某兴趣小组利用三只收集满二氧化碳气体的烧瓶,按如图 1 所示的 装置,利用传感器对二氧化碳性质进行探究。三个注射器内各装入水、饱和石灰水、氢氧化 钠浓溶液,并迅速将注射器内 85ml 液体全部注入烧瓶中,关闭活塞,振荡烧瓶,冷却至室 温;三只烧瓶内气压变化如图 2 所示。

资料 1:Na2CO3 + CO2 + H2O=====2NaHCO3
资料 2:2NaHCO3△Na2CO3 + H2O + CO2↑
试回答下列问题:
(1)曲线 AB 段气压变化的原因是_____。
(2)曲线 2 所代表的实验中发生的反应方程式为_____。
(3)对比曲线 1、2、3,能得出的结论是_____。
A.CO2 能与水发生反应
B.该温度下,1 体积水约溶解 1 体积 CO2
C. NaOH 浓溶液比饱和石灰水更适合吸收二氧化碳
(4)图 1 所示实验中,用“注射器”而不用“长颈漏斗”的原因是_____。
(5)探究曲线 3 所代表的实验后的溶液中溶质的成分:
①取少量该实验后的溶液于试管中,滴入酚酞溶液后溶液呈红色,仅由此现象,定性的 猜想烧瓶内溶液中溶质的成分为(写出所有的可能)_________________ 。(填化学式,下 同)
②将试管加热,未见气泡产生;待试管冷却至室温后,加入足量的 BaCl2 溶液后,出现 白色沉淀,发生的反应方程式为:______;说明该溶液中存在溶质______;此 时溶液还是红色,说明该溶液中还存在溶质_____。
【答案】 液体快速注入容器导致气体压缩,压强增大 Ca(OH)2+CO2═CaCO3↓+H2O ABC 长颈漏斗只能液封,无法做到完全密封,无法准确测量气压变化 Na2CO3和NaOH或Na2CO3 BaCl2+Na2CO3=BaCO3↓+2NaCl Na2CO3 NaOH
【解析】(1)曲线AB段两者还没有充分反应,当液体快速注入容器导致气体压缩,压强增大;(2)曲线2中吸收的二氧化碳的量大于曲线1小于曲线三,故是氢氧化钙与二氧化碳的反应,发生的反应方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,(3)观察、对比曲线1、2、3,可以看出,CO2能与水发生反应,该温度下,1体积水约溶解1体积CO2,NaOH溶液比饱和石灰水更适合吸收二氧化碳;(4)长颈漏斗只能液封,无法做到完全密封,无法准确测量气压变化;(5)①取少量实验后烧瓶中的溶液于试管中,滴入酚酞试液后溶液呈红色,说明溶液呈碱性,故定性的猜想烧瓶内溶液中溶质的成分为可能是Na2CO3和NaOH;Na2CO3;②加入足量的BaCl2 溶液后,出现白色沉淀,是因为Na2CO3和BaCl2反应生成碳酸钡和氯化钠,发生的反应方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl;此时溶液还是红色,说明该溶液中还存在NaOH。

【题目】溶液与人们的生活息息相关。
(1)氯化钠、硝酸钾、氢氧化钙在不同温度时的溶解度如下表所示:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60℃时,氯化钠的溶解度____________硝酸钾的溶解度(填“>”、“<”或“=”)。
②氢氧化钙的饱和溶液加热后变浑浊,原因是____________________________________。
③20℃时,向氢氧化钙的饱和溶液中加入少量生石灰并恢复至20℃,溶液中溶质的质量 _________(填“增大”、“减小”或“不变”)。
④要从含有少量氯化钠的硝酸钾溶液中得到较多的硝酸钾,可以采用加热浓缩、________、过滤的方法,得到的滤液中含有_______________(填离子符号)。
(2)制作“叶脉书签”需要使用质量分数为10%的氢氧化钠溶液。用氢氧化钠固体配制50g质量分数为10%的氢氧化钠溶液,配制过程如下图所示:
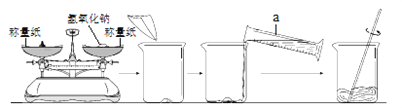
①写出图中标号仪器的名称:a______________。
②指出图中称量步骤的错误操作:_____________________________;_____________________________。
③若用质量分数为25%的氢氧化钠溶液配制50g质量分数为10%的氢氧化钠溶液,所需25%的氢氧化钠溶液和水的质量比为 ______。