题目内容
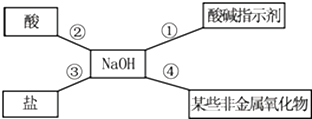
15.通过海水晾晒可得粗盐,粗盐除 NaCl 外,还含有 MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如图:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是加速溶解.
(2)第④步操作加入过量的 Na2CO3目的是除去CaCl2、BaCl2(填化学式).
(3)在第③步操作中,选择的除杂的试剂不能用 KOH 代替 NaOH,理由是会引入新的杂质氯化钾.
(4)在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去过量的氢氧化钠、碳酸钠.
分析 (1)根据从粗盐溶解过程中的玻璃棒的作用进行分析;
(2)根据碳酸钠会与氯化钡生成碳酸钡沉淀和氯化钠,碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠进行分析;
(3)根据从复分解反应得原理以及加入的物质引入的离子角度进行分析;
(4)根据除杂过程中反应剩余的碳酸钠、氢氧化钠对于氯化钠来说也是杂质进行分析.
解答 解:(1)用玻璃棒搅拌,加速了液体的流动,使固体很快溶解;
(2)碳酸钠会与氯化钡生成碳酸钡沉淀和氯化钠,碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,所以第④步操作加入过量的 Na2CO3目的是除去CaCl2、BaCl2;
(3)氢氧化钾会与氯化镁反应生成氢氧化镁沉淀和氯化钾,氯化钾对氯化钠来说就是杂质了;
(4)除杂过程中反应剩余的碳酸钠、氢氧化钠对于氯化钠来说也是杂质,所以在利用粗盐制备精盐过程的第⑥步操作中,加入适量盐酸的目的是除去过量的氢氧化钠、碳酸钠.
故答案为:(1)加速溶解;
(2)CaCl2、BaCl2;
(3)会引入新的杂质氯化钾;
(4)除去过量的氢氧化钠、碳酸钠.
点评 本题主要考查了粗盐提纯过程中的除杂方面的知识,综合性强,双基要求高.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
5.如图所示的实验操作中,正确的是( )
| A. |  倾倒液体 倾倒液体 | B. |  取用固体粉末 | C. |  稀释浓硫酸 | D. |  测液体PH |
6.空气的主要成分中最适合用作食品保护气的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 稀有气体 | D. | 氮气 |
20.英国新一期《自然》杂志刊登电解熔融的铁矿石的炼铁技术:发生的反应原理为:2Fe2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Fe+3X↑.下列与该反应有关的说法中错误的是( )
| A. | X的化学式是O2 | |
| B. | 化学反应前后分子、原子的种类不变 | |
| C. | 上述反应是分解反应 | |
| D. | 该炼铁技术减少二氧化碳的排放,缓解温室效应 |
7.2015年获得诺贝尔奖的中国科学家是( )
| A. |  屠呦呦 | B. |  张青莲 | C. |  侯德榜 | D. |  居里夫人 |

 手机在人们的生活中使用广泛,如图是充电或连接电脑用的数据线.
手机在人们的生活中使用广泛,如图是充电或连接电脑用的数据线.